
【题目】在273K和101kPa的条件下,将2.00g氦气,1.40g氮气和1.60g氧气混合,求:
(1)该混合气体的总物质的量为______________
(2)该混合气体的体积是_______________
(3)该混合气体的平均摩尔质量为_________
【答案】0.6 13.44 8.3
【解析】
(1)分别计算氦气、氮气和氧气的物质的量可得;
(2)依据气体摩尔体积计算可得;
(3)依据摩尔质量公式计算可得。
(1)2.00g氦气的物质的量为![]() =0.5mol,1.40g氮气的物质的量为
=0.5mol,1.40g氮气的物质的量为![]() =0.05mol,1.60g氧气的物质的量为
=0.05mol,1.60g氧气的物质的量为![]() =0.05mol,则混合气体的总物质的量为(0.5+0.05+0.05)mol=0.6mol,故答案为:0.6;
=0.05mol,则混合气体的总物质的量为(0.5+0.05+0.05)mol=0.6mol,故答案为:0.6;
(2)在273K和101kPa的条件下,混合气体的体积为n×Vm=0.6mol×22.4L/mol=13.44L,故答案为:13.44;
(3)混合气体的总质量为(2.00+1.40+1.60)g=5.00g,混合气体的总物质的量为0.6mol,则该混合气体的平均摩尔质量为![]() =8.3g/mol,故答案为:8.3。
=8.3g/mol,故答案为:8.3。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中的原子序数依次增大的同主族元素。回答下列问题:
(1)N2的电子式为_________;锑在元素周期表中的位置为__________。
(2)![]() 中子数与质子数的差值为________。
中子数与质子数的差值为________。
(3)酸性:H3AsO4__H3PO4(填“>”或”<”)请从元素性质角度解释原因_______。
(4)次磷酸(H3PO2)是一种精细化工产品,具有较强的还原性,可用于化学镀银。
①H3PO2与足量的NaOH溶液反应生成NaH2PO2,则H3PO2是______元酸(填“一”、“二”或“三”)。
②H3PO2可将溶液中的银离子还原为银单质,氧化产物为H3PO4。利用H3PO2进行镀银时,氧化剂与还原剂的物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.常温常压下,1.06g Na2CO3含有的Na+离子数目为0.02 NA
B.常温常压下,2NA个CO2分子占有的体积为44.8L
C.标准状况下,22.4LH2O含有的分子数为 NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是
A. 常温常压下,11.2L二氧化碳含有的原子数等于1.5NA
B. 100mL1mol·L-1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,22.4LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为2NA
D. 常温常压下,48gO2与O3混合物含有的氧原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以空气和镁为原料制备 Mg3N2 的装置如图所示(夹持和加热装置略去):
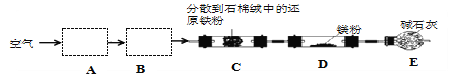
下列说法正确的是( )
A. 装置 A、B 中可依次加入浓硫酸、NaOH 溶液
B. 若去掉装置 C,对产品纯度无影响
C. 实验时应先加热 C,通入一段时间空气后再加热D
D. E 中碱石灰的作用是吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
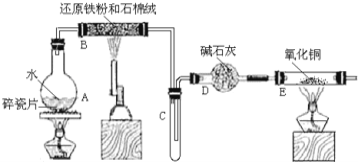
(1)装置B中发生反应的化学方程式是__________________________。
(2)装置E中的现象是_____________________________________。
(3) 该小组学生利用B装置的固体与足量盐酸反应后的滤液制取FeCl3·6H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是______________________________。
② 简述检验滤液中Fe3+的操作方法________________________。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。
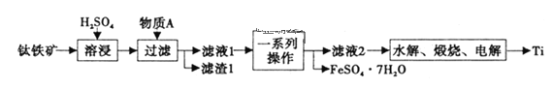
(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为___。
(2)物质A为___(填化学式),“一系列操作”为___。
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有___、___。(写出两条)。
(4)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式___;若反应后的溶液中c(Fe2+)=2×10-6mol·L-1,则溶液中c(CO32-)=___mol·L-1。(已知:KSP(FeCO3)=2.025×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备金属铝的主要原料.工业上提取铝的工艺流程如下:
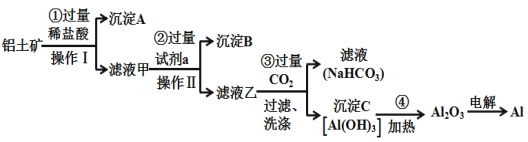
(1)沉淀A的化学式是____,沉淀B的化学式是____,滤液甲中所含金属离子是___、____,试剂a的化学式为__________;
(2)步骤③中通入过量CO2,产生沉淀C的离子方程式为___________________________________;
(3)Al2O3中所含的化学键的类型为________________;
(4)工业上用电解熔融Al2O3的方法制备金属铝,其反应方程式为_____________________________;
(5)在生活中,常利用Al与Fe2O3间的铝热反应来进行焊接钢轨。除了Fe2O3,铝粉还可以与很多金属氧化物组成铝热剂,下列氧化物中不能与铝粉组成铝热剂的是(___________)
a.MgO b.V2O5 c.Fe3O4 d.MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3 杂质。利用明矾石制备氢氧化铝的流程如下:
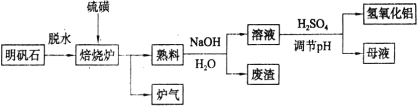
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S=2Al2O3+9SO2,若生成1molAl2O3,则转移的电子数为______。
(2)将标况下1.12L炉气通入100mL0.5mol/LNaOH 溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为______。
(3)熟料溶解时反应的离子方程式为_________。
(4)检验废渣中含有Fe2O3所需的试剂是______________。
(5)母液中溶质主要成分的化学式为_______,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com