
【题目】Ⅰ. 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:
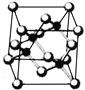
(1)下列说法正确的是__________(填序号)
A.砷化镓晶胞结构与NaCl相同 B.第一电离能 As>Ga
C.电负性 As>Ga D.原子半径 As>Ga
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为_____________________________;
(3)AsH3空间形状为___________;已知(CH3)3 Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ. 金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因_______________________, Cu2+的核外电子排布式为_______________________。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有_________和_________。
【答案】 BC (CH3)3Ga + AsH3 ![]() GaAs + 3CH4 三角锥 sp2 铜是金属晶体,由金属阳离子和自由电子构成,自由电子在外加电场的作用下可发生定向移动 [Ar]3d9 或1s22s22p63s23p63d 9 离子键 配位键
GaAs + 3CH4 三角锥 sp2 铜是金属晶体,由金属阳离子和自由电子构成,自由电子在外加电场的作用下可发生定向移动 [Ar]3d9 或1s22s22p63s23p63d 9 离子键 配位键
【解析】(1)A项,GaAs晶体中As分布于晶胞体心,Ga分布于顶点和面心,而如图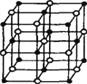 NaCl中阴阳离子分别位于晶胞的顶点、面心以及棱和体心,二者结构不同,故A错误;B项,同周期元素从左到右第一电离能逐渐增大,所以第一电离能:As>Ga,故B正确;C项,同周期元素从左到右电负性逐渐增大,所以电负性:As>Ga,故C正确;D项,同周期从左到右原子半径减小,所以原子半径As<Ga,故D错误。综上,选BC。
NaCl中阴阳离子分别位于晶胞的顶点、面心以及棱和体心,二者结构不同,故A错误;B项,同周期元素从左到右第一电离能逐渐增大,所以第一电离能:As>Ga,故B正确;C项,同周期元素从左到右电负性逐渐增大,所以电负性:As>Ga,故C正确;D项,同周期从左到右原子半径减小,所以原子半径As<Ga,故D错误。综上,选BC。
(2)由已知,反应物为(CH3)3Ga和AsH3,一种生成物为GaAs,根据原子守恒还应有CH4,反应在700℃下进行,化学方程式为:(CH3)3Ga+AsH3![]() GaAs+3CH4。
GaAs+3CH4。
(3)As原子最外层5个电子,AsH3中含有3个δ键和1个孤电子对,为三角锥形,Ga最外层3个电子,(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化。
(4)金属铜能导电是因为铜是金属晶体,由金属阳离子和自由电子构成,自由电子在外加电场的作用下可发生定向移动,从而导电;Cu是29号,故Cu2+的核外电子排布式为[Ar]3d9或1s22s22p63s23p63d9。
(5)[Cu(NH3)4]SO4晶体属于配合物,配离子与硫酸根之间形成离子键、铜离子与氨分子之间形成配位键。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的常见短周期元素,X的某种氢化物能使湿润的红色石蕊试纸变蓝.Y的一种核素质量数为18,中子数为10.在同周期元素中Z的简单离子半径最小,W的单质是良好的半导体材料。下列说法中正确的是
A. 简单气态氢化物稳定性:W >X
B. Y元素的相对原子质量为18
C. X2H4的分子中极性键和非极性键数目比为4:l
D. 电解Z的熔融氯化物可以冶炼单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1 mol氢气中的化学键需要消耗436 kJ能量,拆开1 mol氧气中的化学键需要消耗498 kJ 能量,根据图中的能量图,回答下列问题:

(1)分别写出①②的数值:①___________KJ;②____________KJ。
(2)生成H2O(g)中的1 mol H—O键放出_____________kJ的能量。
(3)已知:H2O(l)==H2O(g) ΔH = + 44 kJ·mol-1,试写出2 mol氢气在足量氧气中完全燃烧生成液态水的热化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用铁片与稀硫酸反应制氢气.下列措施中,不能使氢气生成速率加大的是( )
A.加热
B.不用稀硫酸,改用98%浓硫酸
C.将铁片改为镁条
D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,化合物M对番茄灰霉菌有较好的抑菌活性,其合成路线如下图所示。


完成下列填空:
(1)写出反应类型。
反应③___________ 反应④__________
(2)写出结构简式。
A______________ E_______________________
(3)写出反应②的化学方程式________________
(4)B的含苯环结构的同分异构体中,有一类能发生碱性水解,写出检验这类同分异构体中的官能团(酚羟基除外)的试剂及出现的现象。
试剂(酚酞除外)___________ 现象________________________
(5)写出两种C的含苯环结构且只含4种不同化学环境氢原子的同分异构体的结构简式。_____________
(6)反应①、反应②的先后次序不能颠倒,解释原因。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行下列反应:M(气)+N(气)R(气)+2L(?)此反应符合下面图象,下列叙述正确的是( )
A.正反应放热,L是气体
B.正反应吸热,L是固体
C.正反应吸热,L是气体
D.正反应放热,L是固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)该反应的平衡常数表达式K= .
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验.
实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如表:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL 18molL﹣1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 | |
C | 3mL乙醇、2mL乙酸、6mL 3molL﹣1 H2SO4 | 1.2 | |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是mL和molL﹣1 .
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率.浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是 .
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZnO在医药、石化等领域有广泛的用途。研究小组用某闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3等杂质)制备氧化锌和硫单质,设计如下流程:

请回答下列问题:
(1)滤渣1的化学式为_______,
(2)沉淀X的化学式为______________。
(3)“转化Ⅱ”中主要反应的离子方程式为___________________________。
(4)“一系列操作”包括过滤、洗涤、干燥。洗涤沉淀的操作为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com