
【题目】下列说法正确的是
A.化学键的断裂过程中放出热量
B.化学键形成的过程需要吸收热量
C.伴有能量变化的物质变化都是化学变化
D.化学反应除了生成新的物质外,还伴随着能量的变化
科目:高中化学 来源: 题型:
【题目】下表是食用碘盐包装上的部分说明,下列说法正确的是( )
配料:精盐、碘酸钾、抗结剂
碘含量:35±15 mg/kg
储存方法:密封、避光、防潮
食用方法:烹饪时,待食品熟后加入碘盐
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.可用淀粉检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50 mg/kg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲测定某已部分变质的小苏打样品中Na2CO3的质量分数,设计如下实验方案。
【方案一】称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为_______________。
(2)实验中,需加热至恒重的目的是_______________。
【方案二】称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-==BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为_______________。
(3)实验中判断沉淀是否完全的方法是_______________。
【方案三】按如下图所示装置进行实验:
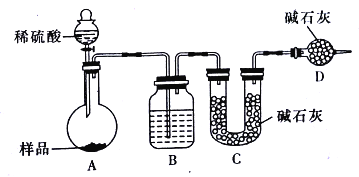
(1)D装置的作用是_______________。分液漏斗中_________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90g样品,实验后测得C装置增重8.80g,则样品中Na2CO3的质量分数为________________(保留三位有效数字)
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存的在一个明显缺陷是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图: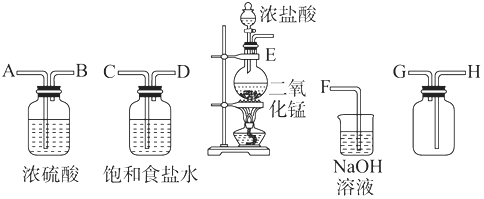
(1)连接上述仪器的正确顺序(填各接口处的字母):接;接;接;接 .
(2)装置中,饱和食盐水的作用是;NaOH溶液的作用是 .
(3)化学实验中常用湿润的淀粉KI试纸检验是否有Cl2产生.如果有Cl2产生,可观察到 , 反应方程式 .
(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应: .
②NaOH溶液中发生的反应: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学反应原理研究氮及其化合物意义重大。请回答下列问题:
(1)已知: N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为_______。
(2)T1温度时,在容积为2 L 的恒容密闭容器中发生反应: 2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2 )消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2) ,k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如图所示:
2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2 )消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2) ,k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如图所示:
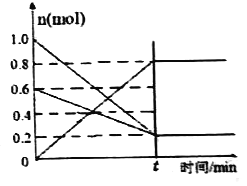
①下列说法能表明该反应已达到平衡状态的是______(填序号)。
A.混合气体的密度不变 B.混合气体的颜色不变
C. k正、k逆不变 D.2v正(O2)= v逆(NO2)
②化学平衡常数K与速率常数k正、k逆的数学关系是K=_______。
③T1温度时,化学平衡常数K=______。将容器的温度改变为T2时,若k正=k逆 ,则T2___T1 (填“>”、“<”或“=”)。
(3) 亚硝酸是氮元素重要的含氧酸之一。25℃,测得amol/LHNO2稀溶液的pH=b,该温度下HNO2电离平衡常数的精确计算表达式为K=______(用含a、b的代数式表示)。将amol/L的NaCN溶液与0.01mol/L的盐酸等体积混合后,测得溶液pH=7,则溶液中![]() =_____(用含a 的代数式表示)。
=_____(用含a 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,

下列说法错误的是
A. B极为原电池的正极
B. A、B、C可能分别为Zn、Cu、稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(HF)2(g)2HF(g),△H>0,且平衡体系的总质量[m(总)]与总物质的量[n(总)]之比在不同温度下随压强的变化曲线如图所示.下列说法正确的是( ) 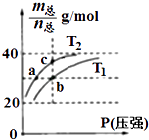
A.温度:T1<T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:Vb>Va
D.当 ![]() =30g/mol时,n(HF):n(HF)2=2:1
=30g/mol时,n(HF):n(HF)2=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料.
(1)以下是工业上合成甲醇的反应:CO(g)+2H2(g)CH3OH(g)△H 下表所列数据是该反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为热反应(填“吸”或“放”).
某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为(从表中选择).
(2)已知在常温常压下: ①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1 kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2 kJ/mol
③H2O(g)=H2O(l)△H3 kJ/mol
则反应 CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=kJ/mol(用△H1、△H2、△H3表示)
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法: 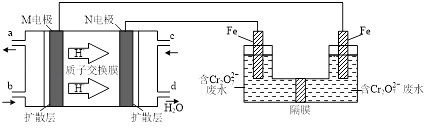
①N电极的电极反应式为 .
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72+Fe2++═Cr3++Fe3++
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-5molL﹣1 时,Cr3+沉淀完全,此时溶液的pH= . (已知,Ksp=6.4×10-31 , lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物元素组成包括 C、H、O、N、P 等,该化合物的功能不可能是
A. 参与细胞膜的构成
B. 催化代谢反应
C. 细胞的储能物质
D. 携带遗传信息
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com