
【题目】除去下列物质中少量杂质的方法正确的是( )
A.除去FeCl2溶液中混有的FeCl3加入过量铁粉,过滤
B.除去NO2中混有的NO:用水洗气
C.除去SO2中混有的HCl:用饱和亚硫酸钠溶液洗气
D.除去Cu粉中混有的Cu0:加适量稀硝酸后,过滤、洗涤
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息,回答下列问题:
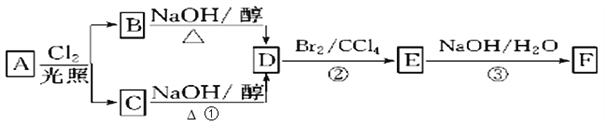
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88gCO2和45gH2O,A的分子式是________________。
(2)B和C均为一氯代烃,已知C中只有一种等效氢,则B的名称(系统命名)为_______。
(3)D的结构简式_____________, ③的反应类型是 ______________。
(4)写出③的反应化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是
A. 元素周期表含元素最多的族是第ⅢB族
B. 元素周期表有18个族
C. 第1 A族的元素全部是金属元素
D. 短周期是指第一、二、三、四周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别处于第二、第三周期的主族元素A和B,它们的离子电子层结构相差两层,已知A处于第m族,B处于第n族,A只有正化合价,则A、B的原子序数分别是( )
A. m、n B. 3、7 C. m-2、10-n D. m+2、n+10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是_______________________;
Y与过量浓硝酸反应后溶液中含有的盐的化学式为__________。
(2)某溶液中含有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________(填字母)。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
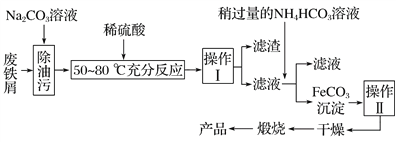
回答下列问题:
①操作Ⅰ的名称是________;操作Ⅱ的名称是________________;
操作Ⅱ的方法为________________________________________________________。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)_______________。
③请完成生成FeCO3沉淀的离子方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一个反应表示二氧化硫被还原 ( )
A. SO2+2H2O+Cl2===H2SO4+2HCl B. SO2+2H2S===2H2O+3S
C. SO2+2NaOH===Na2SO3+H2O D. SO2+Na2CO3===Na2SO3+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。

请按要求回答下列问题:
(1) 写出②的元素名称____________;
(2) 将①、②和③三种元素相比较,非金属性最强的是____________(填元素符号);
(3) 元素⑥的氢化物的化学式为________________________;
(4) 元素④和元素⑤的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以醋酸为例探究弱酸的性质。
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响。
①设计实验方案如下表,表中c =________ mol·L-1。
编号 | 酸的种类 | 酸的浓度/mol·L-1 | 酸的体积/mL | 镁条质量/g |
1 | 醋酸 | 1.0 | 10 | 2.0 |
2 | 盐酸 | c | 10 | 2.0 |
②实验步骤:a)检查装置(左图)的气密性后,添加药品;
b)反应开始后,___________________________(填写操作) ;
c)将所记录的数据转化为曲线图(右图)。

③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:____________。
(2)实验二:现有一瓶醋酸溶液,常温下测定其中醋酸的电离程度(已电离的电解质分子数占原来总分子数的百分比)。
设计实验方案,将待测物理量和对应的测定方法填写在下表中。
待测物理量 | 测定方法 |
①__________ | 量取25.00mL醋酸溶液于锥形瓶中,滴加指示剂,将0.1000 mol·L-1 NaOH标准溶液装入______________中,滴定至终点,记录数据.重复滴定2次. |
②__________ | _______________________________________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com