
【题目】硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号________________ ,该能层具有的原子轨道数为________________、电子数为________________。
(2)硅主要以硅酸盐、________________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________________相结合,其晶胞中共有8个原子,其中在面心位置贡献________________个原子。
(4)单质硅可通过甲硅烷(SiH4) 分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:

硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___________SiH4的稳定性小于CH4,更易生成氧化物,原因是 ________________。
(6)在硅酸盐中,SiO44+四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为________________。Si与O的原子数之比为 ________________ 化学式为________.

【答案】M 9 4 二氧化硅 共价键 3 Mg2Si + 4NH4Cl = SiH4+ 4NH3+ 2MgCl2 C—C键和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成 C—H键的键能大于C—O键,C—H键比C—O键稳定。而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键。 sp3 1∶3 [SiO3] n2n-(或SiO32-)
【解析】
(1)Si原子核外电子数为14,基态原子核外电子排布为1s22s22p63s23p2,据此解答;
(2)硅在自然界中主要以硅酸盐和二氧化硅形式存在;
(3)硅晶体和金刚石晶体类似都属于原子晶体,硅原子之间以共价键结合,在金刚石晶体的晶胞中,每个面心有一个碳原子(晶体硅类似结构),则面心位置贡献的原子为 6×![]() =3个;
=3个;
(4)Mg2Si和NH4Cl在液氨介质中反应制得SiH4、NH3和MgCl2;
(5)①键能越小,化学键越不稳定;
②键能越小,化学键越不稳定,反应倾向于形成稳定性更强方向进行;
(6)硅酸盐中的SiO44-为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;根据图(b)的一个结构单元中含有1个硅、3个氧原子。
(1)硅原子核外有14个电子,其基态原子的核外电子排布式为1s22s22p63s23p2,对应能层分别别为K、L、M,其中能量最高的是最外层M层,该能层有s、p、d三个能级,s能级有1个轨道,p能级有3个轨道,d能级有5个轨道,所以共有9个原子轨道,硅原子的M能层有4个电子(3s23p2);
(2)硅元素在自然界中主要以化合态(二氧化硅和硅酸盐)形式存在;
(3)硅晶体和金刚石晶体类似都属于原子晶体,硅原子之间以共价键结合.在金刚石晶体的晶胞中,每个面心有一个碳原子(晶体硅类似结构),则面心位置贡献的原子为 6×![]() =3个;
=3个;
(4)Mg2Si和NH4Cl在液氨介质中反应制得SiH4、NH3和MgCl2,方程式为:Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2;
(5)①烷烃中的C-C键和C-H键大于硅烷中的Si-Si键和Si-H键的键能,所以硅烷中Si-Si键和Si-H键的键能易断裂,导致长链硅烷难以生成;
②键能越大、物质就越稳定,C-H键的键能大于C-O键,故C-H键比C-O键稳定,而Si-H键的键能远小于Si-O键,所以Si-H键不稳定而倾向与形成稳定性更强的Si-O键;
(6)硅酸盐中的硅酸根(SiO44-)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;故答案为:sp3根据图(b)的一个结构单元中含有1个硅、3个氧原子,化学式为SiO32-。


科目:高中化学 来源: 题型:
【题目】如图所示原电池的总反应为Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s),下列叙述正确的是

A.电子从银电极经导线流向铜电极
B.盐桥中的阳离子向硝酸银溶液中迁移
C.电池工作时,铜电极发生还原反应
D.将AgNO3溶液更换为Fe(NO3)3溶液,电流表指针反向偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深。下列说法中不正确的是

A.电源的M 极为正极
B.甲装置中溶液的pH 减小
C.甲装置的两个电极上都有单质生成且物质的量之比为1︰1
D.欲用乙装置给铜镀银,U 极应该是Ag,电镀液选择AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成xmol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成xmol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为xmol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() xmol
xmol
A.①B.①②C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如图。涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O

(1)碱浸前将铬铁矿粉碎的作用是_______________。
(2)步骤③调节pH后过滤得到的滤渣是____________。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式________。
(4)用简要的文字说明操作⑤加入KC1的原因____________。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I一十S4O52-)
①滴定时淀粉的作用为_______,判断达到滴定终点的依据是_____________。
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应)_____________(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq) = NH4HSO3(aq) ΔH1=a kJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq) = (NH4)2SO3(aq)+H2O(l)ΔH2=b kJ·mol-1;
③2(NH4)2SO3(aq)+O2(g) = 2(NH4)2SO4(aq) ΔH3=c kJ·kJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l) 的ΔH=________kJ·mol-1
(2)燃煤发电厂常利用反应:2CaCO3(s)+2SO2(g)+O2(g) = 2CaSO4(s)+2CO2(g) ΔH=-681.8 kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
0 | 10 | 20 | 30 | 40 | 50 | |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)=________mol·L-1·min-1;当升高温度,该反应的平衡常数K________(填“增大”“减小”或“不变”)。
②30in后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________(填字母)。
A.加入一定量的粉状碳酸钙 B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)N2(g)+CO2(g) ΔH=-34.0 kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
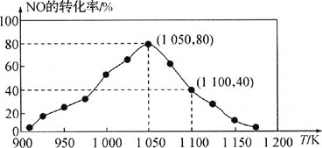
由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________;在1100K时,CO2的体积分数为________。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=________[已知:气体分压(P分)=气体总压(P总)×体积分数]。
(5)工业上常用高浓度的 K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图:
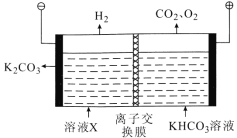
①在阳极区发生的反应包括___________和H++HCO3- =CO2↑+H2O
②简述CO32-在阴极区再生的原理:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池充电时,阳极质量增大
B. 0.1mol ·L-lCH3COONa溶液加热后,溶液的pH减小
C. 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023
D. 室温下,稀释0.1mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物G是合成维生素类药物的中间体,其结构简式如图1所示,G的合成路线如图2所示:
其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去
已知:-CHO+
请回答下列问题:
(1)G的分子式是__,G中官能团的名称是__;
(2)第①步反应的化学方程式是__;
(3)B的名称(系统命名)是__;
(4)第②~⑥步反应中属于取代反应的有__(填步骤编号);
(5)第④步反应的化学方程式是________;
(6)写出同时满足下列条件的E的所有同分异构体的结构简式__,①只含一种官能团;②链状结构且无﹣O﹣O﹣;③核磁共振氢谱只有2种峰。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com