
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成xmol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成xmol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为xmol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() xmol
xmol
A.①B.①②C.①④D.②③
【答案】A
【解析】
反应H2(g)+Br2(g) ![]() 2HBr(g)中,反应方程式两边气体的体积不变,压强不影响化学平衡,只要加入的各物质按照化学计量数完全转化成反应物氢气和溴,满足n(A):n(B)=1molH2:2mol=1:2,就属于等效平衡,反应体系中各组分的含量一定相等,据此进行分析。
2HBr(g)中,反应方程式两边气体的体积不变,压强不影响化学平衡,只要加入的各物质按照化学计量数完全转化成反应物氢气和溴,满足n(A):n(B)=1molH2:2mol=1:2,就属于等效平衡,反应体系中各组分的含量一定相等,据此进行分析。
反应H2(g)+Br2(g) ![]() 2HBr(g)中,反应方程式两边气体的体积不变,压强不影响化学平衡,只要加入的各物质按照化学计量数完全转化成反应物氢气和溴,满足n(A):n(B)=1molH2:2mol=1:2,就属于等效平衡,反应体系中各组分的含量一定相等。①a,b,c满足的关系为:4a+c=2b,就满足Br2和H2的物质的量比为2∶1,选项①正确;②达到平衡时HBr的物质的量为xmol,无法确定Br2和H2的物质的量比,选项②错误;③a、b、c满足的关系为a+b=c很难,且无法确定Br2和H2的物质的量比,选项③错误;④该反应两边气体的体积不变,反应后气体的物质的量还是3mol,溴化氢的含量为
2HBr(g)中,反应方程式两边气体的体积不变,压强不影响化学平衡,只要加入的各物质按照化学计量数完全转化成反应物氢气和溴,满足n(A):n(B)=1molH2:2mol=1:2,就属于等效平衡,反应体系中各组分的含量一定相等。①a,b,c满足的关系为:4a+c=2b,就满足Br2和H2的物质的量比为2∶1,选项①正确;②达到平衡时HBr的物质的量为xmol,无法确定Br2和H2的物质的量比,选项②错误;③a、b、c满足的关系为a+b=c很难,且无法确定Br2和H2的物质的量比,选项③错误;④该反应两边气体的体积不变,反应后气体的物质的量还是3mol,溴化氢的含量为![]() ,达到平衡时两个平衡中溴化氢的含量相等,所以达到平衡时HBr物质的量为
,达到平衡时两个平衡中溴化氢的含量相等,所以达到平衡时HBr物质的量为![]() xmol,选项④错误。故选A。
xmol,选项④错误。故选A。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 取1mL20%蔗糖溶液,加入适量稀硫酸,水浴加热后取少量溶液,加入几滴新制的Cu(OH)2悬浊液,加热没有砖红色沉淀生成 | 溶液中未出现砖红沉淀 | 蔗糖未水解 |
B | 将C和SiO2的固体混合物加热加热 | 2C+SiO2 | 非金属性:C>Si |
C | 向盛有2mL0.1molL-1的NaCl溶液的试管中逐滴加入几滴0.1molL-1AgNO3溶液,充分反应后,再逐滴加入AgNO3溶液,充分反应后,再逐滴加入0.1molL-1的KI溶液 | 白色沉淀变为黄色沉淀 | Ksp(AgCl)>Ksp(Agl), |
D | 向待测液中加入适量的稀NaOH溶液,将湿润的蓝色石蕊试纸放在试管口 | 湿润的蓝色石蕊试纸未变红 | 待测液中不存在NH4+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷结构为立方体,分子式为C8H8,其熔点比相同碳原子的辛烷高,立方烷的结构简式如图所示。下列有关立方烷的说法正确的是( )
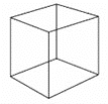
A.其一氯代物只有1种,二氯代物有2种
B.常温常压下为气体
C.与乙苯(结构简式为![]() )是同分异构体
)是同分异构体
D.与苯的含碳质量分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷同为VA族元素,它们的单质和化合物在生产、生活中有广泛应用。回答下列问题:
(1)下列有关氮原子电子排布图中,能量最低和最高的分别为____、___。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(2)![]() 是一种芳环硝化中间体,其中氮原子的杂化轨道类型为____,与
是一种芳环硝化中间体,其中氮原子的杂化轨道类型为____,与![]() 互为等电子体的化合物分子是___(任写一种,填化学式)。
互为等电子体的化合物分子是___(任写一种,填化学式)。
(3)C、N、O是第二周期相邻的三种非金属元素,它们的第一电离能由大到小的顺序为____;NH3是一种极易溶于水的气体,其沸点比AsH3的沸点______(填“低”或“高”),其原因是______。
(4)砷是制造新型半导体的材料,同时砷的化合物又具有较强的毒性。
1918年美国人通过反应:HC≡CH+AsCl3![]() CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为___;AsCl3分子的空间构型为_____。
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为___;AsCl3分子的空间构型为_____。
(5)2018年7月《Science》报道,BingLv等通过反应:4BI3+As4![]() 4BAs+6I2合成了具有极高导热性的半导体新材料BAs。BAs晶胞结构如图所示:
4BAs+6I2合成了具有极高导热性的半导体新材料BAs。BAs晶胞结构如图所示:
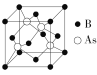
已知该晶胞参数为a pm,NA表示阿伏加德罗常数,则该晶胞的密度ρ=_____g·cm3(用代数式表示,可不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
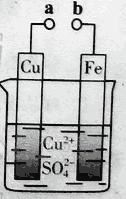
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号________________ ,该能层具有的原子轨道数为________________、电子数为________________。
(2)硅主要以硅酸盐、________________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________________相结合,其晶胞中共有8个原子,其中在面心位置贡献________________个原子。
(4)单质硅可通过甲硅烷(SiH4) 分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:

硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___________SiH4的稳定性小于CH4,更易生成氧化物,原因是 ________________。
(6)在硅酸盐中,SiO44+四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为________________。Si与O的原子数之比为 ________________ 化学式为________.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1mol下列物质完全燃烧生成稳定的产物时放出的热量如下:

则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A.-44.2kJ·mol-1B.44.2kJ·mol-1
C.-330kJ·mol-1D.330kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25°C时,![]() ,
,![]() 。下列说法正确的是
。下列说法正确的是
A.25°C时,饱和![]() 溶液与饱和
溶液与饱和![]() 溶液相比,前者的
溶液相比,前者的![]() 大
大
B.25°C时,在![]() 的悬浊液加入少量的
的悬浊液加入少量的![]() 固体,
固体,![]() 增大
增大
C.25°C时,![]() 固体在20ml0.01 mol·
固体在20ml0.01 mol·![]() 氨水中的
氨水中的![]() 比在20mL0.01mol·
比在20mL0.01mol·![]()
![]() 溶液中的
溶液中的![]() 小
小
D.25°C时,在![]() 的悬浊液加入
的悬浊液加入![]() 溶液后,
溶液后,![]() 不可能转化成为
不可能转化成为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2分子具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,下列说法合理的是
A.N2O的电子式可表示![]()
B.N2O与SiO2为等电子体、具有相似的结构(包括电子式)
C.N2O与CO2均不含非极性键
D.N2O为三角形分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com