
【题目】已知:25°C时,![]() ,
,![]() 。下列说法正确的是
。下列说法正确的是
A.25°C时,饱和![]() 溶液与饱和
溶液与饱和![]() 溶液相比,前者的
溶液相比,前者的![]() 大
大
B.25°C时,在![]() 的悬浊液加入少量的
的悬浊液加入少量的![]() 固体,
固体,![]() 增大
增大
C.25°C时,![]() 固体在20ml0.01 mol·
固体在20ml0.01 mol·![]() 氨水中的
氨水中的![]() 比在20mL0.01mol·
比在20mL0.01mol·![]()
![]() 溶液中的
溶液中的![]() 小
小
D.25°C时,在![]() 的悬浊液加入
的悬浊液加入![]() 溶液后,
溶液后,![]() 不可能转化成为
不可能转化成为![]()
科目:高中化学 来源: 题型:
【题目】铜的氯化物是重要的化工原料,常用作有机合成催化剂。实验室用粗铜(含杂质Fe)制备氯化亚铜、氯化铜晶体的流程如下:

下列说法错误的是
A.固体1和固体2中Fe元素的价态相同
B.检验溶液2中的杂质离子是否除尽可以选用KSCN溶液或铁氰化钾溶液
C.试剂X可能是CuO,操作②中结晶时需要通入HC1气体
D.反应②的离子方程式为2Cu2++SO2+2H2O+2C1-=2CuC1↓+SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成xmol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成xmol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为xmol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() xmol
xmol
A.①B.①②C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq) = NH4HSO3(aq) ΔH1=a kJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq) = (NH4)2SO3(aq)+H2O(l)ΔH2=b kJ·mol-1;
③2(NH4)2SO3(aq)+O2(g) = 2(NH4)2SO4(aq) ΔH3=c kJ·kJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l) 的ΔH=________kJ·mol-1
(2)燃煤发电厂常利用反应:2CaCO3(s)+2SO2(g)+O2(g) = 2CaSO4(s)+2CO2(g) ΔH=-681.8 kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
0 | 10 | 20 | 30 | 40 | 50 | |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)=________mol·L-1·min-1;当升高温度,该反应的平衡常数K________(填“增大”“减小”或“不变”)。
②30in后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________(填字母)。
A.加入一定量的粉状碳酸钙 B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)N2(g)+CO2(g) ΔH=-34.0 kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
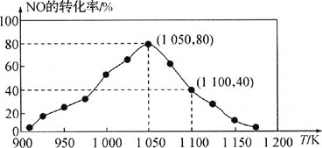
由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________;在1100K时,CO2的体积分数为________。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=________[已知:气体分压(P分)=气体总压(P总)×体积分数]。
(5)工业上常用高浓度的 K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图:
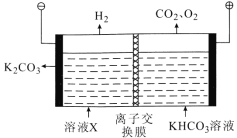
①在阳极区发生的反应包括___________和H++HCO3- =CO2↑+H2O
②简述CO32-在阴极区再生的原理:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种信息材料的添加剂,在相同条件下,A蒸气是同体积氢气质量的88.25倍。在A分子中各元素质量分数分别为w(C)=54.4%,w(H)=7.4%,w(O)=18.1%,w(Cl)=20.1%,A在不同条件下可发生如图所示的一系列变化。
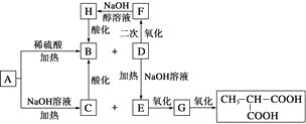
请回答下列问题:
(1)A的分子式为__________。
(2)D分子含有的官能团是________________。
(3)上述转换关系的化学方程式中,属于水解反应的有________个(填数字)。
(4)写出化学方程式:
①A和稀硫酸共热:____________________________________________________;
②E氧化成G:__________________________________________________;
③F与氢氧化钠醇溶液共热:__________________________________________。
(5)与B互为同分异构体的且属于链状酯的物质共有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池充电时,阳极质量增大
B. 0.1mol ·L-lCH3COONa溶液加热后,溶液的pH减小
C. 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023
D. 室温下,稀释0.1mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图所示与对应叙述相符的是
A.  表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) <Ksp(CuS)
表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) <Ksp(CuS)
B.  pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C.  表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D.  反应N2(g)+3H2(g)
反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯:

环己醇、环己烯的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
环己烯 | 83(70.8)* | 0.8085 | 不溶于水 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物中有机物的质量分数
Ⅰ:制备环己烯粗品。实验中将环己醇与浓硫酸混合加入烧瓶中,按图所示装置,油浴加热,蒸馏约1h,收集馏分,得到主要含环己烯和水的混合物。

Ⅱ:环己烯的提纯。主要操作有;
a.向馏出液中加入精盐至饱和;
b.加入3~4mL5%Na2CO3溶液;
c.静置,分液;
d.加入无水CaCl2固体;
e.蒸馏
回答下列问题:
(1)油浴加热过程中,温度控制在90℃以下,蒸馏温度不宜过高的原因是________。
(2)蒸馏不能彻底分离环己烯和水的原因是_______________。
(3)加入精盐至饱和的目的是_____________________。
(4)加入3~4mL5%Na2CO3溶液的作用是__________。
(5)加入无水CaCl2固体的作用是______________。
(6)利用核磁共振氢谱可以鉴定制备的产物是否为环己烯,环己烯分子中有_______种不同环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物X的结构简式如图所示,下列有关叙述不正确的是

A.X能使KMnO4溶液褪色
B.X在一定条件下能与FeCl3溶液发生显色反应
C.X在一定条件下能发生消去反应和酯化反应
D.1molX分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3mol、4mol、1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com