
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如图。涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O

(1)碱浸前将铬铁矿粉碎的作用是_______________。
(2)步骤③调节pH后过滤得到的滤渣是____________。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式________。
(4)用简要的文字说明操作⑤加入KC1的原因____________。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I一十S4O52-)
①滴定时淀粉的作用为_______,判断达到滴定终点的依据是_____________。
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应)_____________(保留2位有效数字)。
【答案】增大接触面积,增大反应速率 Al(OH)3、 H2SiO3 2CrO42-+2H+Cr2O72-+H2O 温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应可以得到重铬酸钾 指示剂 当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去,且半分钟内不恢复 94%
【解析】
铬铁矿与纯碱、氢氧化钠、氯酸钾反应6FeO·Cr2O3+24NaOH+7KClO3= 12Na2CrO4+3Fe2O3+7KCl+12H2O,氧化铝、二氧化硅也反应变为偏铝酸钠、硅酸钠,步骤②过滤出氧化铁,将滤液调节pH,沉淀铝和硅变为氢氧化铝和硅酸,过滤、酸化滤液,将铬酸根变为重铬酸根,利用重铬酸钾溶解度随温度变化较大的特点加KCl发生复分解反应得到重铬酸钾;利用淀粉作指示剂来测定重铬酸钾的含量,根据方程式得到关系式进行计算。
(1)碱浸前将铬铁矿粉碎的作用是增大接触面积,增大反应速率;故答案为:增大接触面积,增大反应速率。
(2)步骤②过滤氧化铁,滤液中含有偏铝酸根和硅酸根,步骤③调节pH后过滤得到的滤渣是Al(OH)3、H2SiO3;故答案为:Al(OH)3、H2SiO3。
(3)操作④中,酸化时,CrO42-在酸性条件下转化为Cr2O72-,写出平衡转化的离子方程式2CrO42-+2H+Cr2O72-+H2O;故答案为:2CrO42-+2H+Cr2O72-+H2O。
(4) 操作⑤加入KC1反应生成重铬酸钾和氯化钠,利用重铬酸钾的溶解度受温度影响大,发生复分解反应得到重铬酸钾;故答案为:温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应可以得到重铬酸钾。
(5)①单质碘与淀粉变蓝,因此滴定时淀粉的作用为指示剂,判断达到滴定终点的依据是当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去,且半分钟内不恢复;故答案为:指示剂;当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去,且半分钟内不恢复。
②根据方程式得出关系式为
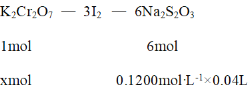
![]()
解得x = 0.0008mol
![]() ;故答案为:94%。
;故答案为:94%。


科目:高中化学 来源: 题型:
【题目】Hg 是水体污染的重金属元素之一。水溶液中的二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中涉及的物质或粒子只有Hg(OH)2 为难溶物,粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-1gc(Cl-)]:

下列说法中错误的是
A. Hg(NO3)2固体溶于水通常会出现浑浊
B. 海水Cl-的浓度大于0.1mol/L,则其中汞元素的主要存在形态是Hg(OH)2
C. 少量Hg(NO3)2溶于0.001moL/L盐酸后得到澄清透明溶液
D. 已知Ksp(HgS)=1.6×10-52,当c(S2-)=1×10-5mo/L 时,c(Hg2+)=1.6×10-47mo/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:

(1)“550℃焙烧”的目的是_____________________________。
(2)“浸出液”的主要成分是__________________。
(3)“钴浸出”过程中Co3+转化为Co2+,该反应的离子方程式为_________________________。
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是__________________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-6mol/L,则滤液中c(Mg2+)为__________________。[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
(6)为测定制得样品的纯度,现称取1.000g样品,将其用适当试剂转化,得到草酸铵溶液,再用过量稀硫酸酸化,用0.1000mol/LKMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液24.00mL,则草酸钴样品的纯度为___________。
(7)取一定质量的CoC2O4·2H2O分解后的钴氧化物(Co的化合价为+2、+3),用480ml 5mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如右图所示。以下有关该物质的说法中正确的是( )
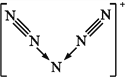
A. 每个N5+中含有35个质子和36个电子
B. 该离子中有非极性键和配位键
C. 该离子中含有2个π键
D. 与PCl4+互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号________________ ,该能层具有的原子轨道数为________________、电子数为________________。
(2)硅主要以硅酸盐、________________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________________相结合,其晶胞中共有8个原子,其中在面心位置贡献________________个原子。
(4)单质硅可通过甲硅烷(SiH4) 分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:

硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___________SiH4的稳定性小于CH4,更易生成氧化物,原因是 ________________。
(6)在硅酸盐中,SiO44+四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为________________。Si与O的原子数之比为 ________________ 化学式为________.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根皮素J(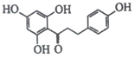 )是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
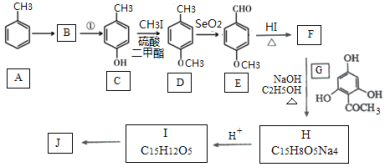
已知:
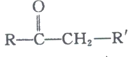 +R’’CHO
+R’’CHO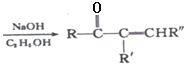 +H2O
+H2O
回答下列问题:
(1)C的化学名称是___________.E中的官能团的名称为_______________.
(2)B为溴代烃,请写出A→B的反应条件___________.
(3)写出由C生成D和由D生成E的反应类型___________、___________.
(4)F→H的化学方程式为______________________.
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①能与FeCl3溶液发生显色反应 ②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线_______(无机试剂任选).
的合成路线_______(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
常温时,FeCl3的水溶液呈___(填“酸”“中”或“碱”)性,原因是___(用离子方程式表示);实验室配制0.01mol·L-1FeCl3的溶液时,为了抑制FeCl3的水解使溶液中不产生沉淀可加入少量的盐酸至溶液pH不大于___;若把配制的FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是___。(常温下Fe(OH)3的溶度积Ksp=1.0×10-38)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰气的分子式为(CN)2,结构式为N![]() C-C
C-C![]() N,其性质与卤素单质相似,下列叙述不正确的是( )
N,其性质与卤素单质相似,下列叙述不正确的是( )
A.N![]() C键的键能大于C
C键的键能大于C![]() C键的键能B.(CN)2分子中含有3个σ键和2个π键
C键的键能B.(CN)2分子中含有3个σ键和2个π键
C.N![]() C键的键长小于C
C键的键长小于C![]() C键的键长D.(CN)2能与NaOH溶液反应
C键的键长D.(CN)2能与NaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com