
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
常温时,FeCl3的水溶液呈___(填“酸”“中”或“碱”)性,原因是___(用离子方程式表示);实验室配制0.01mol·L-1FeCl3的溶液时,为了抑制FeCl3的水解使溶液中不产生沉淀可加入少量的盐酸至溶液pH不大于___;若把配制的FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是___。(常温下Fe(OH)3的溶度积Ksp=1.0×10-38)
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答下列问题:
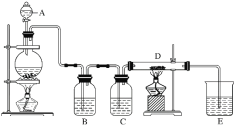
(1)仪器A的名称是________,烧瓶中反应的化学方程式是___________。
(2)装置B中盛放液体是_______,气体通过装置B的目的是___________。
装置C中盛放的液体是________,气体通过装置C的目的是____________。
(3)D中反应的化学方程式是__________________。
(4)烧杯E中盛放的液体是________,反应的化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如图。涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O

(1)碱浸前将铬铁矿粉碎的作用是_______________。
(2)步骤③调节pH后过滤得到的滤渣是____________。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式________。
(4)用简要的文字说明操作⑤加入KC1的原因____________。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I一十S4O52-)
①滴定时淀粉的作用为_______,判断达到滴定终点的依据是_____________。
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应)_____________(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中含有两种溶质NaCl和H2SO4,且n(NaCl): n(H2SO4)=3:1。若以石墨电极电解该混合液时根据电极产物,可明显分为三个阶段,下列叙述中不正确的是( )
A. 阴极自始至终只析出H2 B. 阳极先析出Cl2,后析出O2
C. 电解最后阶段为电解水 D. 电解液的pH不断增大,最终等于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池充电时,阳极质量增大
B. 0.1mol ·L-lCH3COONa溶液加热后,溶液的pH减小
C. 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023
D. 室温下,稀释0.1mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组依据氧化还原反应:___(用离子方程式表示)设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过___mol电子。

(2)如图其他条件不变,某同学将(1)中盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞溶液,溶液变红,电极反应为___;乙装置中石墨(1)为____极(填“正”“负”“阴”或“阳”)。

(3)如图为工业上用惰性电极电解Na2CO3溶液的原理。阳极的电极反应式为___,阴极产生的物质A的化学式为___。

(4)某同学以甲烷燃料电池为电源,以石墨为电极电解足量Na2CO3溶液,一段时间后,在电解池两极上共产生6.72L气体(标准状况下),此时甲烷燃料电池中共消耗甲烷____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.C3H8中碳原子都采用的是sp3杂化
B.O2、CO2、N2都是非极性分子
C.酸性:H2CO3<H3PO4<H2SO4<HClO
D.CO的一种等电子体为NO+,它的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写反应的化学方程式或离子方程式:
(1)某地污水中的有机污染物主要成分是三氯乙烯![]() ,向此污水中加入
,向此污水中加入![]() 高锰酸钾被还原为
高锰酸钾被还原为![]() 溶液可将其中的三氯乙烯除去,氧化产物只有
溶液可将其中的三氯乙烯除去,氧化产物只有![]() ,写出该反应的化学方程式:_____________。
,写出该反应的化学方程式:_____________。
(2)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉![]() ,同时产生二氧化碳气体,该反应的离子方程式为_______。
,同时产生二氧化碳气体,该反应的离子方程式为_______。
(3)已知![]() 能与稀硫酸反应,生成一种淡黄色不溶物和一种气体
能与稀硫酸反应,生成一种淡黄色不溶物和一种气体![]() 标准状况下的密度为
标准状况下的密度为![]() ,写出该反应的离子方程式:______。
,写出该反应的离子方程式:______。
(4)一定条件下,向![]() 溶液中滴加碱性
溶液中滴加碱性![]() 溶液,溶液中
溶液,溶液中![]() 元素的化合价为
元素的化合价为![]() 与
与![]() 反应生成纳米铁粉、
反应生成纳米铁粉、![]() 和
和![]() ,其离子方程式为_____________。
,其离子方程式为_____________。
(5)![]() 与碘化钾在稀硫酸中反应的离子方程式为_____________。
与碘化钾在稀硫酸中反应的离子方程式为_____________。
(6)![]() 还原性较强,在溶液中易被
还原性较强,在溶液中易被![]() 氧化成
氧化成![]() ,常用作脱氯剂,该反应的离子方程式为_____________。
,常用作脱氯剂,该反应的离子方程式为_____________。
(7)![]() 可与KOH和
可与KOH和![]() 在高温下反应,生成产物之一为
在高温下反应,生成产物之一为![]() ,反应的化学方程式为_____________。
,反应的化学方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com