
【题目】按要求书写反应的化学方程式或离子方程式:
(1)某地污水中的有机污染物主要成分是三氯乙烯![]() ,向此污水中加入
,向此污水中加入![]() 高锰酸钾被还原为
高锰酸钾被还原为![]() 溶液可将其中的三氯乙烯除去,氧化产物只有
溶液可将其中的三氯乙烯除去,氧化产物只有![]() ,写出该反应的化学方程式:_____________。
,写出该反应的化学方程式:_____________。
(2)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉![]() ,同时产生二氧化碳气体,该反应的离子方程式为_______。
,同时产生二氧化碳气体,该反应的离子方程式为_______。
(3)已知![]() 能与稀硫酸反应,生成一种淡黄色不溶物和一种气体
能与稀硫酸反应,生成一种淡黄色不溶物和一种气体![]() 标准状况下的密度为
标准状况下的密度为![]() ,写出该反应的离子方程式:______。
,写出该反应的离子方程式:______。
(4)一定条件下,向![]() 溶液中滴加碱性
溶液中滴加碱性![]() 溶液,溶液中
溶液,溶液中![]() 元素的化合价为
元素的化合价为![]() 与
与![]() 反应生成纳米铁粉、
反应生成纳米铁粉、![]() 和
和![]() ,其离子方程式为_____________。
,其离子方程式为_____________。
(5)![]() 与碘化钾在稀硫酸中反应的离子方程式为_____________。
与碘化钾在稀硫酸中反应的离子方程式为_____________。
(6)![]() 还原性较强,在溶液中易被
还原性较强,在溶液中易被![]() 氧化成
氧化成![]() ,常用作脱氯剂,该反应的离子方程式为_____________。
,常用作脱氯剂,该反应的离子方程式为_____________。
(7)![]() 可与KOH和
可与KOH和![]() 在高温下反应,生成产物之一为
在高温下反应,生成产物之一为![]() ,反应的化学方程式为_____________。
,反应的化学方程式为_____________。
【答案】![]()
![]()
![]()
![]() 2Fe(纳米铁粉)+6H2↑+2BO2-
2Fe(纳米铁粉)+6H2↑+2BO2- ![]()
![]() 3MnO2+KClO3+6KOH
3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
【解析】
(1)根据高锰酸钾的还原产物为![]() 知,该反应中高锰酸钾作氧化剂,被还原生成二氧化锰,则
知,该反应中高锰酸钾作氧化剂,被还原生成二氧化锰,则![]() 是还原剂,被氧化生成
是还原剂,被氧化生成![]() ,根据元素守恒知,还生成KCl、HCl,分析价态变化,依据守恒,可书写方程式;
,根据元素守恒知,还生成KCl、HCl,分析价态变化,依据守恒,可书写方程式;
(2)甲酸钠和氢氧化钠混合液与![]() 反应生成保险粉
反应生成保险粉![]() 的同时生成二氧化碳和
的同时生成二氧化碳和![]() ,由原子和电子、电荷守恒可写出反应的离子方程式。
,由原子和电子、电荷守恒可写出反应的离子方程式。
(3)Fe3S4能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标准状况下的密度为1.518g/L),淡黄色不溶物为S,气体的相对分子质量为![]() ,为
,为![]() 气体,S元素的化合价升高,则Fe元素的化合价降低,还应生成硫酸亚铁,由电子、电荷守恒可知反应的离子方程式;
气体,S元素的化合价升高,则Fe元素的化合价降低,还应生成硫酸亚铁,由电子、电荷守恒可知反应的离子方程式;
(4)向![]() 溶液中滴加碱性
溶液中滴加碱性![]() 溶液,溶液中
溶液,溶液中![]() 元素的化合价为
元素的化合价为![]() 与
与![]() 反应生成纳米铁粉、
反应生成纳米铁粉、![]() 和
和![]() ,由此可写出反应的离子方程式。
,由此可写出反应的离子方程式。
(5)ClO2与酸性碘化钾溶液反应,氧化![]() 为
为![]() ,自身被还原为
,自身被还原为![]() ,由此可写出反应的离子方程式。
,由此可写出反应的离子方程式。
(6)Na2S2O3还原性较强,在溶液中易被![]() 氧化成
氧化成![]() ,氯气被还原为氯离子,由此可写出离子反应。
,氯气被还原为氯离子,由此可写出离子反应。
(7)MnO2可与KOH和![]() 在高温下反应,生成产物之一为
在高温下反应,生成产物之一为![]() ,因锰元素价态升高,根据氧化还原反应规律知,氯元素的化合价降低,利用守恒法,可写出化学方程式。
,因锰元素价态升高,根据氧化还原反应规律知,氯元素的化合价降低,利用守恒法,可写出化学方程式。
(1)根据高锰酸钾的还原产物为![]() 知,该反应中高锰酸钾作氧化剂,被还原生成二氧化锰,则
知,该反应中高锰酸钾作氧化剂,被还原生成二氧化锰,则![]() 是还原剂,被氧化生成
是还原剂,被氧化生成![]() ,根据元素守恒知,还生成KCl、HCl,该反应中C元素化合价由
,根据元素守恒知,还生成KCl、HCl,该反应中C元素化合价由![]() 变为
变为![]() 、Mn元素化合价由
、Mn元素化合价由![]() 变为
变为![]() ,根据反应物和生成物书写方程式为
,根据反应物和生成物书写方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)甲酸钠和氢氧化钠混合液与![]() 反应生成保险粉
反应生成保险粉![]() 的同时生成二氧化碳和
的同时生成二氧化碳和![]() ,由原子和电子、电荷守恒可知,反应的离子方程式为
,由原子和电子、电荷守恒可知,反应的离子方程式为![]() ,故答案为:
,故答案为:![]()
(3)Fe3S4能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标准状况下的密度为1.518g/L),淡黄色不溶物为S,气体的相对分子质量为![]() ,为
,为![]() 气体,S元素的化合价升高,则Fe元素的化合价降低,还应生成硫酸亚铁,由电子、电荷守恒可知反应的离子方程式为
气体,S元素的化合价升高,则Fe元素的化合价降低,还应生成硫酸亚铁,由电子、电荷守恒可知反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)向![]() 溶液中滴加碱性
溶液中滴加碱性![]() 溶液,溶液中
溶液,溶液中![]() 元素的化合价为
元素的化合价为![]() 与
与![]() 反应生成纳米铁粉、
反应生成纳米铁粉、![]() 和
和![]() ,反应中只有Fe、H元素化合价发生变化,发生氧化还原反应,离子方程式为
,反应中只有Fe、H元素化合价发生变化,发生氧化还原反应,离子方程式为![]() 2Fe(纳米铁粉)+6H2↑+2BO2-,故答案为:
2Fe(纳米铁粉)+6H2↑+2BO2-,故答案为:![]() 2Fe(纳米铁粉)+6H2↑+2BO2-。
2Fe(纳米铁粉)+6H2↑+2BO2-。
(5)ClO2与酸性碘化钾溶液反应,氧化![]() 为
为![]() ,自身被还原为
,自身被还原为![]() ,同时生成水,反应离子方程式为
,同时生成水,反应离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(6)Na2S2O3还原性较强,在溶液中易被![]() 氧化成
氧化成![]() ,氯气被还原为氯离子,离子反应为
,氯气被还原为氯离子,离子反应为![]() ,故答案为:
,故答案为:![]() ;
;
(7)MnO2可与KOH和![]() 在高温下反应,生成产物之一为
在高温下反应,生成产物之一为![]() ,因锰元素价态升高,根据氧化还原反应规律知,氯元素的化合价降低,所以产物中还有KCl生成,结合元素守恒,产物中还有
,因锰元素价态升高,根据氧化还原反应规律知,氯元素的化合价降低,所以产物中还有KCl生成,结合元素守恒,产物中还有![]() 生成,所以化学方程式为3MnO2+KClO3+6KOH
生成,所以化学方程式为3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O,故答案为:3MnO2+KClO3+6KOH
3K2MnO4+KCl+3H2O,故答案为:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O。
3K2MnO4+KCl+3H2O。


科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
常温时,FeCl3的水溶液呈___(填“酸”“中”或“碱”)性,原因是___(用离子方程式表示);实验室配制0.01mol·L-1FeCl3的溶液时,为了抑制FeCl3的水解使溶液中不产生沉淀可加入少量的盐酸至溶液pH不大于___;若把配制的FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是___。(常温下Fe(OH)3的溶度积Ksp=1.0×10-38)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰气的分子式为(CN)2,结构式为N![]() C-C
C-C![]() N,其性质与卤素单质相似,下列叙述不正确的是( )
N,其性质与卤素单质相似,下列叙述不正确的是( )
A.N![]() C键的键能大于C
C键的键能大于C![]() C键的键能B.(CN)2分子中含有3个σ键和2个π键
C键的键能B.(CN)2分子中含有3个σ键和2个π键
C.N![]() C键的键长小于C
C键的键长小于C![]() C键的键长D.(CN)2能与NaOH溶液反应
C键的键长D.(CN)2能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含a mol NaClO的溶液通入b mol SO2充分反应(不考虑二氧化硫与水之间的反应以及次氯酸的分解)。下列说法不正确的是
A.当0<b<a/3时:SO2+H2O+3ClO-=![]() +2HClO+Cl-
+2HClO+Cl-
B.当b=a时,SO2+H2O+ClO-==2H++Cl-+![]()
C.当a/3≤b≤a时,反应后溶液中H+的物质的量: 0<n(H+)≤2b mol
D.当0<b<a时,反应后溶液中ClO-、Cl-和![]() 物质的量之比为:(a-b)∶b∶b
物质的量之比为:(a-b)∶b∶b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类赖以生存和发展的重要物质基础,回答下列问题:
(1)下列生产工艺能获取新型无机非金属材料的是 ______ (填序号)。
①采用甲烷为原料,在微波和其他条件下生产金刚石
②采用传统方法用焦炭还原SiO2制备单晶硅
③在水泥生产过程中加入高炉矿渣生产特殊用途的水泥
④在玻璃生产过程中加入K、Pb生产其有特殊用途的光学玻璃
(2)某炼铁高炉中一次投入磁铁矿冶炼生铁,若该过程中转移的电子为1.60×105mol,不考虑其他的反应,也不考虑生铁中的杂质,则炼得的生铁为 ______t。生铁中含碳、硫等元素较多,炼钢是以生铁为原料,除去过多的碳、硫等杂质元素,其中除去硫的化学方程式为 ______。
(3)工业炼金属Al的工艺流程如下:

该工艺中冰晶石和氟化钙的作用是 ______,物质W的化学式为 ______ ;若铝土矿的纯度为60%,提取W的损失率为3%,电解时损失率为0.1%,粗铝净化时的损失率为2%,铝锭中铝的含量为99.9%,那么1.0t铝土矿可制备铝锭 ______t。
(4)金属腐蚀带来的损失无法估量。钢铁腐蚀多为吸氧腐蚀,其正极反应式为 ______,金属防腐措施很多,其中牺牲阳极(金属Zn)的阴极保护法的“阴极”反应式为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出过量铁粉与稀硝酸反应的离子方程式 ______ ; 在标准状况下,当生成2.24LNO气体时,转移电子的物质的量为 ______ mol,有 ______ mol氧化剂被还原.
(2)将MnO4-氧化Fe2+的离子方程式补充完整:______________ MnO4-+ ______ Fe2++ ______ =Mn2++ ______ Fe3++ ______。
(3)完成“氧化除铁”步骤中反应的离子方程式: __________________ Fe(OH)2+ ______ ClO-+ ______ ![]() ______ Fe(OH)3+ ______Cl-。
______ Fe(OH)3+ ______Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应的反应物和产物如下,请按要求回答下列问题![]() :
:
(1)如果该化学方程式中S和![]() 的系数分别是5和1,请配平化学方程式
的系数分别是5和1,请配平化学方程式![]() ,并用单线桥标出电子转移的方向和数目:______。
,并用单线桥标出电子转移的方向和数目:______。
(2)该反应中,发生氧化反应的物质是___,该反应中,发生还原反应的过程是____。
(3)反应中,1mol还原剂________![]() 填“得到”或“失去”
填“得到”或“失去”![]() ________mol电子。
________mol电子。
(4)若在标准状况下,反应产生336ml气体,则转移的电子数为________个。
(5)如果没有对该化学方程式中的某些化学计量数做限定,配平的化学计量数有许多组,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性![]() ,氧化性
,氧化性![]() 在含3mol
在含3mol![]() 的溶液中逐滴加入
的溶液中逐滴加入![]() 溶液,加入
溶液,加入![]() 和析出
和析出![]() 的物质的量的关系曲线如图所示.则下列有关说法正确的是( )
的物质的量的关系曲线如图所示.则下列有关说法正确的是( )
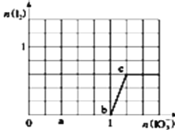
A.b点时的还原产物可能是![]()
B.当![]() 时,溶液中
时,溶液中![]()
C.a点时剩余![]() 的物质的量为
的物质的量为![]()
D.反应过程中的氧化反应所得产物均为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+H2O![]() HClO+H++Cl- K2=10-3.4
HClO+H++Cl- K2=10-3.4
HClO![]() H++ClO- Ka=?
H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )
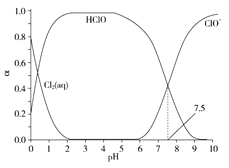
A.Cl2(g)+H2O![]() 2H++ClO-+Cl- K=10-10.9
2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com