
【题目】(1)请写出过量铁粉与稀硝酸反应的离子方程式 ______ ; 在标准状况下,当生成2.24LNO气体时,转移电子的物质的量为 ______ mol,有 ______ mol氧化剂被还原.
(2)将MnO4-氧化Fe2+的离子方程式补充完整:______________ MnO4-+ ______ Fe2++ ______ =Mn2++ ______ Fe3++ ______。
(3)完成“氧化除铁”步骤中反应的离子方程式: __________________ Fe(OH)2+ ______ ClO-+ ______ ![]() ______ Fe(OH)3+ ______Cl-。
______ Fe(OH)3+ ______Cl-。
【答案】![]()
![]()
![]() 1、5、8H+、1、5、
1、5、8H+、1、5、![]()
![]() ;1;
;1;![]() ;2;1
;2;1
【解析】
(1)铁与过量的稀硝酸反应生成硝酸亚铁、NO和水,根据氮元素的化合价变化为![]() ,结合得失电子守恒和氮原子守恒解答;
,结合得失电子守恒和氮原子守恒解答;
(2)MnO4-氧化![]() ,Mn元素的化合价由
,Mn元素的化合价由![]() 价降低为
价降低为![]() 价,Fe元素的化合价由
价,Fe元素的化合价由![]() 价升高为
价升高为![]() 价,结合电子、电荷守恒及原子守恒分析;
价,结合电子、电荷守恒及原子守恒分析;
(3) “氧化除铁”是加入漂白粉,产物中有氯离子,氧化剂是![]() ,观察方程式前后可以推出还要加入水分子,配平方程式即可。
,观察方程式前后可以推出还要加入水分子,配平方程式即可。
(1)过量铁与稀硝酸反应生成硝酸亚铁、NO和水,其反应的离子方程式为:![]() ,标准状况下,当生成
,标准状况下,当生成![]() 气体时,其物质的量为
气体时,其物质的量为![]() ,转移
,转移![]() 电子,氮元素的化合价变化为
电子,氮元素的化合价变化为![]() ,由N原子守恒可知,
,由N原子守恒可知,![]() 氧化剂被还原,故答案为:
氧化剂被还原,故答案为:![]() ;
;![]() ;
;![]() ;
;
(2)反应中![]() ,
,![]() ,
,![]() 系数为5,由元素守恒可知,
系数为5,由元素守恒可知,![]() 系数为5,由电荷守恒可知,由
系数为5,由电荷守恒可知,由![]() 参加反应,其系数为8,根据元素原子守恒可知,有
参加反应,其系数为8,根据元素原子守恒可知,有![]() 生成,其系数为4,方程式配平为
生成,其系数为4,方程式配平为![]() ,故答案为:1、5、8H+、1、5、
,故答案为:1、5、8H+、1、5、![]() ;
;
![]() “氧化除铁”是加入漂白粉,产物中有氯离子,氧化剂是
“氧化除铁”是加入漂白粉,产物中有氯离子,氧化剂是![]() ,观察方程式前后可以推出还要加入水分子,反应的离子方程式为:
,观察方程式前后可以推出还要加入水分子,反应的离子方程式为:![]() ,故答案为:2;1;
,故答案为:2;1;![]() ;2;1。
;2;1。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组依据氧化还原反应:___(用离子方程式表示)设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过___mol电子。

(2)如图其他条件不变,某同学将(1)中盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞溶液,溶液变红,电极反应为___;乙装置中石墨(1)为____极(填“正”“负”“阴”或“阳”)。

(3)如图为工业上用惰性电极电解Na2CO3溶液的原理。阳极的电极反应式为___,阴极产生的物质A的化学式为___。

(4)某同学以甲烷燃料电池为电源,以石墨为电极电解足量Na2CO3溶液,一段时间后,在电解池两极上共产生6.72L气体(标准状况下),此时甲烷燃料电池中共消耗甲烷____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌.某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为_____________;
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_____________操作。
(3)浸出液“净化”过程中加入的主要物质为_____________,其作用是_______。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是_____________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸![]() 是二元酸,
是二元酸,![]() 溶液存在电离平衡:
溶液存在电离平衡:![]() 亚磷酸与足量NaOH溶液反应,生成
亚磷酸与足量NaOH溶液反应,生成![]() .
.

![]() 写出亚磷酸与少量NaOH溶液反应的离子方程式 _______________;
写出亚磷酸与少量NaOH溶液反应的离子方程式 _______________;
![]() 某温度下,
某温度下,![]() 的
的![]() 溶液pH的读数为
溶液pH的读数为![]() ,即此时溶液中
,即此时溶液中![]() ,除
,除![]() 之外其他离子的浓度由小到大的顺序是 _____________,该温度下
之外其他离子的浓度由小到大的顺序是 _____________,该温度下![]() 电离平衡的平衡常数
电离平衡的平衡常数![]() ___________。
___________。![]() 第二步电离忽略不计,结果保留两位有效数字
第二步电离忽略不计,结果保留两位有效数字![]()
![]() 向
向![]() 溶液中滴加NaOH溶液至中性,所得溶液中
溶液中滴加NaOH溶液至中性,所得溶液中![]() ___________
___________ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 _____________;
亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 _____________;
![]() 电解
电解![]() 溶液也可得到亚磷酸,装置示意图如图:说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
溶液也可得到亚磷酸,装置示意图如图:说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
![]() 阴极的电极反应式为 ________________;
阴极的电极反应式为 ________________;
![]() 产品室中反应的离子方程式为 ______________。
产品室中反应的离子方程式为 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写反应的化学方程式或离子方程式:
(1)某地污水中的有机污染物主要成分是三氯乙烯![]() ,向此污水中加入
,向此污水中加入![]() 高锰酸钾被还原为
高锰酸钾被还原为![]() 溶液可将其中的三氯乙烯除去,氧化产物只有
溶液可将其中的三氯乙烯除去,氧化产物只有![]() ,写出该反应的化学方程式:_____________。
,写出该反应的化学方程式:_____________。
(2)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉![]() ,同时产生二氧化碳气体,该反应的离子方程式为_______。
,同时产生二氧化碳气体,该反应的离子方程式为_______。
(3)已知![]() 能与稀硫酸反应,生成一种淡黄色不溶物和一种气体
能与稀硫酸反应,生成一种淡黄色不溶物和一种气体![]() 标准状况下的密度为
标准状况下的密度为![]() ,写出该反应的离子方程式:______。
,写出该反应的离子方程式:______。
(4)一定条件下,向![]() 溶液中滴加碱性
溶液中滴加碱性![]() 溶液,溶液中
溶液,溶液中![]() 元素的化合价为
元素的化合价为![]() 与
与![]() 反应生成纳米铁粉、
反应生成纳米铁粉、![]() 和
和![]() ,其离子方程式为_____________。
,其离子方程式为_____________。
(5)![]() 与碘化钾在稀硫酸中反应的离子方程式为_____________。
与碘化钾在稀硫酸中反应的离子方程式为_____________。
(6)![]() 还原性较强,在溶液中易被
还原性较强,在溶液中易被![]() 氧化成
氧化成![]() ,常用作脱氯剂,该反应的离子方程式为_____________。
,常用作脱氯剂,该反应的离子方程式为_____________。
(7)![]() 可与KOH和
可与KOH和![]() 在高温下反应,生成产物之一为
在高温下反应,生成产物之一为![]() ,反应的化学方程式为_____________。
,反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列化学方程式或离子方程式:
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___。
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___。
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaClO溶液吸收NO尾气,可提高尾气中NO的去除率。其他条件相同时,NO(转化为![]() )的转化率随NaClO溶液初始pH用稀硫酸调节
)的转化率随NaClO溶液初始pH用稀硫酸调节![]() 的变化如图所示。下列说法正确的是
的变化如图所示。下列说法正确的是
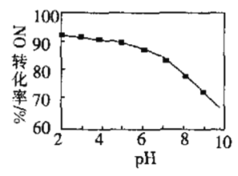
A.HClO氧气NO的能力比NaClO强
B.向NaClO溶液中通入NO后,溶液pH增大
C.若要吸收4.48LNO,则消耗3molNaClO
D.NaClO溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,甲、乙两池中均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始时先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流表指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是( )

A. 闭合K1,断开K2后,A电极增重
B. 闭合K1,断开K2后,乙池溶液浓度上升
C. 断开K1,闭合K2后,A电极发生氧化反应
D. 断开K1,闭合K2后,NO![]() 向B电极移动
向B电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)常温时,0.1molL-1NH4Al(SO4)2溶液的pH=3。
①溶液的Kw=______(填数值),由水电离的c(H+)=_____molL-1。
②溶液中c(NH4+)+c(NH3H2O)_____c(Al3+)+c(Al(OH)3)(填>”“=”“<”);
2c(SO42-)﹣c(NH4+)﹣3c(Al3+)=_______molL-1(计算式);
(2)80℃时,0.1molL-1NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是______;
(3)常温时,向100mL0.1molL-1NH4HSO4溶液中滴加0.1molL-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。
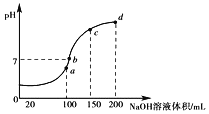
①图中a、b、c、d四个点中水的电离程度最小的是______。
②向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为______。
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是_____。
(4)NH4Al(SO4)2可做净水剂,写出工业制金属铝的化学方程式______;
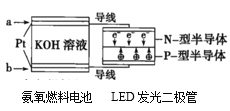
(5)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。电池反应为4NH3+3O2=2N2+6H2O;请写出通入a气体一极的电极反应式为______;每消耗3.4gNH3转移电子的物质的量为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com