
【题目】按要求写出下列化学方程式或离子方程式:
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___。
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___。
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为___。
【答案】PbO2+4HCl(浓)![]() PbCl2+Cl2↑+2H2O 4KClO3
PbCl2+Cl2↑+2H2O 4KClO3![]() KCl+3KClO4 S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
KCl+3KClO4 S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
【解析】
(1)PbO2与浓盐酸共热生成的黄绿色气体为Cl2,同时有PbCl2和水;
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,一种是无氧酸盐,应为KCl,另一种盐的阴阳离子个数比为1:1,由电子转移守恒可知该盐为KClO4;
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,氯气被还原生成氯离子。
(1)PbO2与浓盐酸共热生成的黄绿色气体为Cl2,发生反应的化学方程式为PbO2+4HCl(浓)![]() PbCl2+Cl2↑+2H2O;
PbCl2+Cl2↑+2H2O;
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,一种是无氧酸盐,应为KCl,另一种盐的阴阳离子个数比为1:1,由电子转移守恒可知该盐为KClO4,反应方程式为:4KClO3![]() KCl+3KClO4;
KCl+3KClO4;
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,氯气被还原生成氯离子,离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】化工生产与人类进步紧密相联。下列有关说法不正确的是
A. 空气吹出法提取海水中溴通常使用SO2作还原剂
B. 侯氏制碱法工艺流程中利用了物质溶解度的差异
C. 合成氨采用高温、高压和催化剂主要是提高氢气平衡转化率
D. 工业用乙烯直接氧化法制环氧乙烷体现绿色化学和原子经济
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1molO2与金属Na反应,O2一定得到4NA个电子
B.18gNH4+中所含的电子数为11NA
C.1molFe与足量的Cl2反应,转移的电子数为2NA
D.1molCl2与足量的Fe反应,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求完成下列各题。
(1)将2molL-1Al2(SO4)3和0.2molL-1H2SO4溶液等体积混合(设混合溶液体积等于两溶液体积之和),计算混合液中c(SO42-)=___molL-1.若用容量瓶以质量分数为98%、密度为1.84g/cm3的浓硫酸,配制480mL浓度成0.2molL-1稀硫酸,计算需要量取___mL的浓硫酸。(读到小数点后一位)
(2)在标准状况下,由CO和CO2组成的混合气体6.72L,质量为12g。此混合物中CO和CO2分子数目之比是___,混合气体的平均摩尔质量是___。
(3)还原铁粉与高温水蒸气反应的化学方程式:___。
(4)除去Mg粉中的Al粉的试剂是___,反应的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为___。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式___,配制的FeCl3溶液应保持酸性,原因是__。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+I3-
②I3-+2S2O32-=S4O62-+3I-
现取20.00mL含Cu2+的溶液,加入足量的KI充分反应后,用0.1000mol·L-1的Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00mL,此溶液中Cu2+的浓度为__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铝浸入![]() 溶液中,取出晾干,置于空气中,表面会生成毛状物质(俗称毛刷),反应为4Al(Hg)+3O2+2xH2O→2(Al2O3xH2O),下列说法正确的是( )
溶液中,取出晾干,置于空气中,表面会生成毛状物质(俗称毛刷),反应为4Al(Hg)+3O2+2xH2O→2(Al2O3xH2O),下列说法正确的是( )
A.![]() 发生氧化反应,
发生氧化反应,![]() 是氧化剂
是氧化剂
B.![]() 既是氧化产物也是还原产物
既是氧化产物也是还原产物
C.该反应属于置换反应
D.当![]() 铝参加反应,转移电子数为
铝参加反应,转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
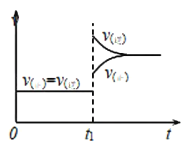
【题目】对于反应![]() ,减小压强,平衡向______(填“正反应”或“逆反应”)方向移动,平衡混合气体的平均相对分子质量在平衡移动时______(填“是”或“否”)发生改变,其原因是____________;下图是反应速率与时间的关系图,
,减小压强,平衡向______(填“正反应”或“逆反应”)方向移动,平衡混合气体的平均相对分子质量在平衡移动时______(填“是”或“否”)发生改变,其原因是____________;下图是反应速率与时间的关系图,![]() 时刻引起正、逆反应速率变化的原因可能是____________(写一条合理原因)。
时刻引起正、逆反应速率变化的原因可能是____________(写一条合理原因)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保水剂是一种强吸水树脂,能在短时间内吸收自身重量几百倍至上千倍的水分。聚丙烯酸钠就是一种高吸水性树脂。下面是丙烯合成聚丙烯酸钠的化工流程:

(1)上述反应中属于加成反应的有____________,反应⑧的反应类型为____________;
(2)若(1)的反应条件为通过溴的四氯化碳溶液,请写出A的结构简式____________;D中官能团名称是____________。
(3)请写出C→D的化学反应方程式__________________。
(4)![]() 是
是![]() 的同系物,式量比
的同系物,式量比![]() 大14,写出2种符合下列要求的
大14,写出2种符合下列要求的![]() 的同分异构体:①链状分子;②与新制氢氧化铜在加热条件下反应生成砖红色沉淀;③与
的同分异构体:①链状分子;②与新制氢氧化铜在加热条件下反应生成砖红色沉淀;③与![]() 溶液混合后滴入酚酞,加热,溶液颜色变浅。__________、___________
溶液混合后滴入酚酞,加热,溶液颜色变浅。__________、___________
(5)检验反应(4)是否全部转化的实验方案__________________。
(6)丙酮(![]() )是一种常用的化工试剂,请设计一条由丙烯制备丙酮的合成路线。(合成路线常用的表示方式为:
)是一种常用的化工试剂,请设计一条由丙烯制备丙酮的合成路线。(合成路线常用的表示方式为:![]() )
)
____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有___ 种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为____________________________。
(2)经测定发现,N2O5固体由NO2+ 和NO3-两种离子组成,该固体中N原子杂化类型为_________;与NO2+互为等电子体的微粒有_______(写出一种)。
(3)HF和HI电离出H+较难的是________(填化学式,下同)。铵盐大多不稳定,请预测NH4F、NH4I中,较易分解的是________。
(4)第二周期中,第一电离能介于B元素和N元素间的元素为_____(填“元素符号”)。
(5)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体( 见图I),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由_______个硼原子构成;若该结构单元中有2 个原子为10B(其余为11B),那么该结构单元有_____种不同类型。
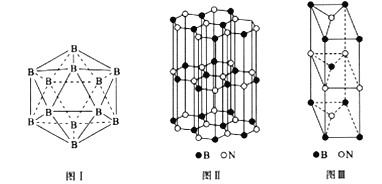
(6)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似,B、N原子相互交替排列(见图II),其晶胞结构如图III所示。该晶胞有_____个B和_____个N。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com