
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌.某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为_____________;
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_____________操作。
(3)浸出液“净化”过程中加入的主要物质为_____________,其作用是_______。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是_____________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为_____________。
【答案】ZnO 浸出 Zn粉 置换出Fe杂质 O2 2ZnS+4H++O2=2Zn2++2S↓+2H2O
【解析】
由流程图离子,硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用。
(1)含锌矿的主要成分是ZnS,与空气中氧气发生氧化还原反应,则焙砂的主要成分为ZnO,故答案为:ZnO;
(2)焙烧生成的含硫氧化物可转换为硫酸,用于后续的浸出操作,故答案为:浸出;
(3)该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉出去亚铁离子,从而除去Fe,故答案为:Zn粉;置换出Fe杂质;
(4)电解沉积过程中,是电解ZnSO4,阳极发生氧化反应,产物为O2,故答案为:O2;
(5)“氧压酸浸”法顾名思义,可知反应物中含有H+和O2,可以获得非金属单质S,反应的化学方程式为2ZnS+4H++O2=2Zn2++2S↓+2H2O,故答案为:2ZnS+4H++O2=2Zn2++2S↓+2H2O。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)糖类、油脂、蛋白质和维生素都是人类的基本营养物质,下表为某品牌燕麦片标签中的一部分。

该燕麦片的营养成分中,能与水反应生成氨基酸的营养物质是_________,每克营养物质氧化时放出能量最多的是_________,一般营养、健康类杂志中提到的“碳水化合物”是指_________,人体必需的微量元素是_________;
(2)维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失,因此,烹调富含维生素C的食物时,应该注意_________;在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点_________;
(3)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:

则羊毛的编号为_________,棉花的编号为_________,涤纶的编号为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰气的分子式为(CN)2,结构式为N![]() C-C
C-C![]() N,其性质与卤素单质相似,下列叙述不正确的是( )
N,其性质与卤素单质相似,下列叙述不正确的是( )
A.N![]() C键的键能大于C
C键的键能大于C![]() C键的键能B.(CN)2分子中含有3个σ键和2个π键
C键的键能B.(CN)2分子中含有3个σ键和2个π键
C.N![]() C键的键长小于C
C键的键长小于C![]() C键的键长D.(CN)2能与NaOH溶液反应
C键的键长D.(CN)2能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有机物完全燃烧,生成CO2和H2O,将12 g该有机物完全燃烧产物通过浓硫酸,浓硫酸增重14.4 g,再通过碱石灰,又增重26.4 g。则该有机物的分子式为( )
A. C4H10 B. C2H6O
C. C3H8O D. C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含a mol NaClO的溶液通入b mol SO2充分反应(不考虑二氧化硫与水之间的反应以及次氯酸的分解)。下列说法不正确的是
A.当0<b<a/3时:SO2+H2O+3ClO-=![]() +2HClO+Cl-
+2HClO+Cl-
B.当b=a时,SO2+H2O+ClO-==2H++Cl-+![]()
C.当a/3≤b≤a时,反应后溶液中H+的物质的量: 0<n(H+)≤2b mol
D.当0<b<a时,反应后溶液中ClO-、Cl-和![]() 物质的量之比为:(a-b)∶b∶b
物质的量之比为:(a-b)∶b∶b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出过量铁粉与稀硝酸反应的离子方程式 ______ ; 在标准状况下,当生成2.24LNO气体时,转移电子的物质的量为 ______ mol,有 ______ mol氧化剂被还原.
(2)将MnO4-氧化Fe2+的离子方程式补充完整:______________ MnO4-+ ______ Fe2++ ______ =Mn2++ ______ Fe3++ ______。
(3)完成“氧化除铁”步骤中反应的离子方程式: __________________ Fe(OH)2+ ______ ClO-+ ______ ![]() ______ Fe(OH)3+ ______Cl-。
______ Fe(OH)3+ ______Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | H | ||||||
2 | C | ||||||
3 | Na | Mg | P | S | Cl |
(1)周期表中第三周期第ⅡA族的元素是_____。
(2)P、S、Cl三种元素中,非金属性最强的是____(填元素符号)。
(3)钠元素最高价氧化物对应水化物的化学式是____,常温下该水化物溶液的pH____(填“>”“<”或“=”)7。
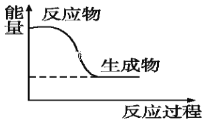
(4)如图为木炭在氧气中燃烧的能量变化图,此反应为____(填“放热”或“吸热”)反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com