
【题目】氰气的分子式为(CN)2,结构式为N![]() C-C
C-C![]() N,其性质与卤素单质相似,下列叙述不正确的是( )
N,其性质与卤素单质相似,下列叙述不正确的是( )
A.N![]() C键的键能大于C
C键的键能大于C![]() C键的键能B.(CN)2分子中含有3个σ键和2个π键
C键的键能B.(CN)2分子中含有3个σ键和2个π键
C.N![]() C键的键长小于C
C键的键长小于C![]() C键的键长D.(CN)2能与NaOH溶液反应
C键的键长D.(CN)2能与NaOH溶液反应
科目:高中化学 来源: 题型:
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如图。涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O

(1)碱浸前将铬铁矿粉碎的作用是_______________。
(2)步骤③调节pH后过滤得到的滤渣是____________。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式________。
(4)用简要的文字说明操作⑤加入KC1的原因____________。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I一十S4O52-)
①滴定时淀粉的作用为_______,判断达到滴定终点的依据是_____________。
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应)_____________(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.C3H8中碳原子都采用的是sp3杂化
B.O2、CO2、N2都是非极性分子
C.酸性:H2CO3<H3PO4<H2SO4<HClO
D.CO的一种等电子体为NO+,它的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物G是合成维生素类药物的中间体,其结构简式如图1所示,G的合成路线如图2所示:
其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去
已知:-CHO+
请回答下列问题:
(1)G的分子式是__,G中官能团的名称是__;
(2)第①步反应的化学方程式是__;
(3)B的名称(系统命名)是__;
(4)第②~⑥步反应中属于取代反应的有__(填步骤编号);
(5)第④步反应的化学方程式是________;
(6)写出同时满足下列条件的E的所有同分异构体的结构简式__,①只含一种官能团;②链状结构且无﹣O﹣O﹣;③核磁共振氢谱只有2种峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌.某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为_____________;
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_____________操作。
(3)浸出液“净化”过程中加入的主要物质为_____________,其作用是_______。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是_____________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
|
|
| 产生黄绿色气体 |
|
| 溶液变蓝 | |
|
| 溶液变红 | |
|
| 产生白色沉淀 | |
下列判断不正确的是![]()
![]()
A.实验![]() 中发生的主要反应是
中发生的主要反应是![]()
B.实验![]() 中发生的主要反应是
中发生的主要反应是![]()
C.实验![]() 中该条件下氧化性强弱
中该条件下氧化性强弱![]()
D.实验![]() 中
中![]() 与
与![]() 相互促进水解
相互促进水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写反应的化学方程式或离子方程式:
(1)某地污水中的有机污染物主要成分是三氯乙烯![]() ,向此污水中加入
,向此污水中加入![]() 高锰酸钾被还原为
高锰酸钾被还原为![]() 溶液可将其中的三氯乙烯除去,氧化产物只有
溶液可将其中的三氯乙烯除去,氧化产物只有![]() ,写出该反应的化学方程式:_____________。
,写出该反应的化学方程式:_____________。
(2)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉![]() ,同时产生二氧化碳气体,该反应的离子方程式为_______。
,同时产生二氧化碳气体,该反应的离子方程式为_______。
(3)已知![]() 能与稀硫酸反应,生成一种淡黄色不溶物和一种气体
能与稀硫酸反应,生成一种淡黄色不溶物和一种气体![]() 标准状况下的密度为
标准状况下的密度为![]() ,写出该反应的离子方程式:______。
,写出该反应的离子方程式:______。
(4)一定条件下,向![]() 溶液中滴加碱性
溶液中滴加碱性![]() 溶液,溶液中
溶液,溶液中![]() 元素的化合价为
元素的化合价为![]() 与
与![]() 反应生成纳米铁粉、
反应生成纳米铁粉、![]() 和
和![]() ,其离子方程式为_____________。
,其离子方程式为_____________。
(5)![]() 与碘化钾在稀硫酸中反应的离子方程式为_____________。
与碘化钾在稀硫酸中反应的离子方程式为_____________。
(6)![]() 还原性较强,在溶液中易被
还原性较强,在溶液中易被![]() 氧化成
氧化成![]() ,常用作脱氯剂,该反应的离子方程式为_____________。
,常用作脱氯剂,该反应的离子方程式为_____________。
(7)![]() 可与KOH和
可与KOH和![]() 在高温下反应,生成产物之一为
在高温下反应,生成产物之一为![]() ,反应的化学方程式为_____________。
,反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
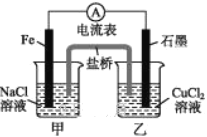
(1)如图所示为某实验小组设计的原电池装置,依据的氧化还原为(用离子反应方程式表示)_____________________________________。
反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过_____mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________,这是由于NH4Cl溶液显____(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因:_____________________,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式:_________________________________________。
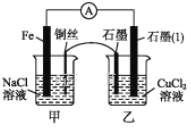
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞溶液,现象是________________,电极反应为_________________________;乙装置中石墨(1)为____(填“正”“负”“阴”或“阳”)极,乙装置中与铜丝相连石墨电极上发生的反应式为________________,产物常用___________________ 检验,反应的离子方程式为 _____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com