
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
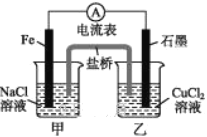
(1)如图所示为某实验小组设计的原电池装置,依据的氧化还原为(用离子反应方程式表示)_____________________________________。
反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过_____mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________,这是由于NH4Cl溶液显____(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因:_____________________,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式:_________________________________________。
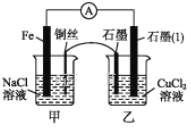
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞溶液,现象是________________,电极反应为_________________________;乙装置中石墨(1)为____(填“正”“负”“阴”或“阳”)极,乙装置中与铜丝相连石墨电极上发生的反应式为________________,产物常用___________________ 检验,反应的离子方程式为 _____________________________________________。
【答案】Fe+Cu2+=Cu+Fe2+ 0.2 2H++2e-=H2↑ 酸性 NH4++H2O![]() NH3·H2O+H+ 2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+ 溶液变红 O2+2H2O+4e-=4OH- 阴 2Cl--2e-=Cl2↑ 湿润淀粉碘化钾试纸 Cl2+2I-=I2+2Cl-
NH3·H2O+H+ 2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+ 溶液变红 O2+2H2O+4e-=4OH- 阴 2Cl--2e-=Cl2↑ 湿润淀粉碘化钾试纸 Cl2+2I-=I2+2Cl-
【解析】
(1)分析题图可知,Fe棒在反应中失电子,作原电池的负极,乙烧杯中的铜离子得电子,石墨作原电池的正极。
(2)NH4Cl属于强酸弱碱盐,NH4+水解溶液显酸性,正极上H+得电子发生还原反应;根据电子守恒、原子守恒和电荷守恒写离子方程式。
(3)甲烧杯中为原电池,乙烧杯中为电解池,甲烧杯中Fe为负极,Cu为正极,据此分析作答。
(1)Fe棒为负极,Fe发生失电子的氧化反应:Fe-2e-=Fe2+,石墨为正极,溶液中铜离子发生得电子的还原反应:Cu2++2e-=Cu,所以依据的氧化还原反应为Fe+Cu2+=Cu+Fe2+,假设导线中通过的电子的物质的量为2xmol,则xmolFe被氧化,xmol铜离子被还原,则56x+64x=12g,解得x=0.1,即导线中通过了0.2mol电子;
(2)若将CuCl2溶液换为NH4Cl溶液,由于NH4Cl溶液中存在水解NH4++H2O![]() NH3·H2O+H+,溶液显酸性,溶液中的氢离子在正极发生还原反应,电极反应式为2H++2e-=H2↑;根据得失电子守恒、原子守恒和电荷守恒,可写出铁离子被氯气氧化的方程式为2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+;
NH3·H2O+H+,溶液显酸性,溶液中的氢离子在正极发生还原反应,电极反应式为2H++2e-=H2↑;根据得失电子守恒、原子守恒和电荷守恒,可写出铁离子被氯气氧化的方程式为2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+;
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则甲烧杯为原电池,乙烧杯为电解池。甲烧杯中Fe为负极,铜丝为正极,由于NaCl溶液呈中性,铜丝上的电极反应为O2+4e-+2H2O=4OH-,故在甲装置铜丝附近滴加酚酞溶液,现象是溶液变红;乙烧杯中石墨(1)为阴极,与铜丝相连的石墨为阳极,该电极上发生的电极反应式为2Cl--2e-=Cl2↑,常用湿润淀粉碘化钾试纸检验Cl2,反应原理为Cl2+2I-=I2+2Cl-。


科目:高中化学 来源: 题型:
【题目】氰气的分子式为(CN)2,结构式为N![]() C-C
C-C![]() N,其性质与卤素单质相似,下列叙述不正确的是( )
N,其性质与卤素单质相似,下列叙述不正确的是( )
A.N![]() C键的键能大于C
C键的键能大于C![]() C键的键能B.(CN)2分子中含有3个σ键和2个π键
C键的键能B.(CN)2分子中含有3个σ键和2个π键
C.N![]() C键的键长小于C
C键的键长小于C![]() C键的键长D.(CN)2能与NaOH溶液反应
C键的键长D.(CN)2能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应的反应物和产物如下,请按要求回答下列问题![]() :
:
(1)如果该化学方程式中S和![]() 的系数分别是5和1,请配平化学方程式
的系数分别是5和1,请配平化学方程式![]() ,并用单线桥标出电子转移的方向和数目:______。
,并用单线桥标出电子转移的方向和数目:______。
(2)该反应中,发生氧化反应的物质是___,该反应中,发生还原反应的过程是____。
(3)反应中,1mol还原剂________![]() 填“得到”或“失去”
填“得到”或“失去”![]() ________mol电子。
________mol电子。
(4)若在标准状况下,反应产生336ml气体,则转移的电子数为________个。
(5)如果没有对该化学方程式中的某些化学计量数做限定,配平的化学计量数有许多组,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性![]() ,氧化性
,氧化性![]() 在含3mol
在含3mol![]() 的溶液中逐滴加入
的溶液中逐滴加入![]() 溶液,加入
溶液,加入![]() 和析出
和析出![]() 的物质的量的关系曲线如图所示.则下列有关说法正确的是( )
的物质的量的关系曲线如图所示.则下列有关说法正确的是( )
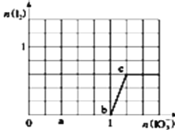
A.b点时的还原产物可能是![]()
B.当![]() 时,溶液中
时,溶液中![]()
C.a点时剩余![]() 的物质的量为
的物质的量为![]()
D.反应过程中的氧化反应所得产物均为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液仅含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的4种离子,所含离子的物质的量均为
中的4种离子,所含离子的物质的量均为![]() 。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法错误的是( )
。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法错误的是( )
A.该溶液中所含的离子是:![]() 、
、![]() 、
、![]() 、
、![]()
B.若向该溶液中加入过量的稀硫酸和![]() 溶液,溶液显血红色
溶液,溶液显血红色
C.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
D.若向该溶液中加入足量的![]() 溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为
溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | H | ||||||
2 | C | ||||||
3 | Na | Mg | P | S | Cl |
(1)周期表中第三周期第ⅡA族的元素是_____。
(2)P、S、Cl三种元素中,非金属性最强的是____(填元素符号)。
(3)钠元素最高价氧化物对应水化物的化学式是____,常温下该水化物溶液的pH____(填“>”“<”或“=”)7。
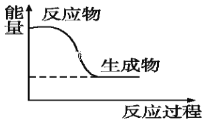
(4)如图为木炭在氧气中燃烧的能量变化图,此反应为____(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图像的叙述正确的是
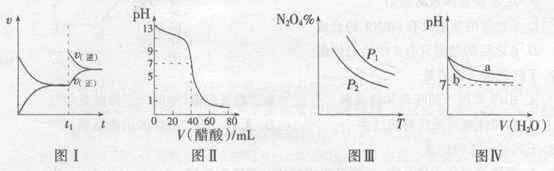
A.图I表示:反应I2(g)+H2(g) ![]() 2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
B.图Ⅱ表示:25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液的滴定曲线,其中c(CH3COOH)=0.1000mol/L
C.图Ⅲ表示:反应2NO2(g) ![]() N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
D.图Ⅳ表示:25℃时,分别稀释等体积,等pH的NaOH溶液与氨水时的pH变化,其中曲线a对应氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+H2O![]() HClO+H++Cl- K2=10-3.4
HClO+H++Cl- K2=10-3.4
HClO![]() H++ClO- Ka=?
H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )
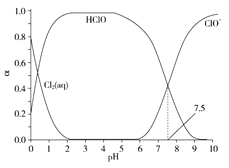
A.Cl2(g)+H2O![]() 2H++ClO-+Cl- K=10-10.9
2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种降血压药物硝苯地平的合成路线如下:

已知:
 +R”’CHO
+R”’CHO
(1)A 的结构简式是 ___________。
(2)B与新制Cu(OH)2 反应的化学方程式是 ______________。
(3)H → I的反应类型是 _______________。
(4)试剂a 是 _______________。
(5)J→K的化学反应方程式是 ___________。
(6)F 有多种同分异构体,写出满足下列条件的一种同分异构体的结构简式__________。
①分子中含有酯基,且存在顺反异构
②能与金属Na单质反应,且能发生银镜反应
(7)1 mol 硝苯地平最多可与__________mol NaOH溶液发生水解反应。
(8)已知 D![]() E→F +CH3OH,E的结构简式是_______________。
E→F +CH3OH,E的结构简式是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com