
【题目】关于下列图像的叙述正确的是
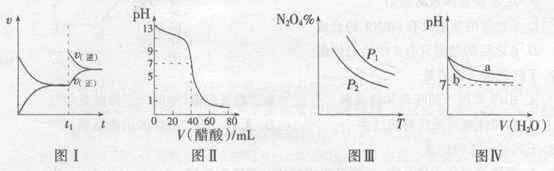
A.图I表示:反应I2(g)+H2(g) ![]() 2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
B.图Ⅱ表示:25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液的滴定曲线,其中c(CH3COOH)=0.1000mol/L
C.图Ⅲ表示:反应2NO2(g) ![]() N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
D.图Ⅳ表示:25℃时,分别稀释等体积,等pH的NaOH溶液与氨水时的pH变化,其中曲线a对应氨水
【答案】D
【解析】
试题分析:A.I2(g)+H2(g) ![]() 2HI(g) 的反应是放热反应。升高温度,正、逆化学反应速率都加快。由于温度对吸热反应影响较大,所以根据平衡移动原理,化学平衡向吸热反应方向移动。所以逆反应速率增大的多。所以平衡向逆反应方向移动。错误。B.在25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液,当恰好完全反应时, n(NaOH)=n(CH3COOH) .但由于生成的CH3COONa是强碱弱酸盐,水解使溶液的pH>7。若使溶液的pH=7,则CH3COOH应该稍微过量。因此c(CH3COOH) >0.1000mol/L.错误。C.由图像可以看出:在压强不变时,升高温度,N2O4的含量降低。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,逆反应方向为吸热反应,所以 该反应的正反应为放热反应。△H<0。在温度不变时,增大压强,平衡正向移动,N2O4的含量增大。所以p1>p2.错误。D. 25℃时,等pH的NaOH溶液与氨水,由于NaOH为强碱,完全电离,而NH3·H2O是弱碱,部分电离,因此c(NH3·H2O)>c(NaOH).当稀释相同的倍数时,由于NH3·H2O会继续电离产生OH-。因此溶液的pH变化较小。因此其中曲线a对应氨水。正确。
2HI(g) 的反应是放热反应。升高温度,正、逆化学反应速率都加快。由于温度对吸热反应影响较大,所以根据平衡移动原理,化学平衡向吸热反应方向移动。所以逆反应速率增大的多。所以平衡向逆反应方向移动。错误。B.在25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液,当恰好完全反应时, n(NaOH)=n(CH3COOH) .但由于生成的CH3COONa是强碱弱酸盐,水解使溶液的pH>7。若使溶液的pH=7,则CH3COOH应该稍微过量。因此c(CH3COOH) >0.1000mol/L.错误。C.由图像可以看出:在压强不变时,升高温度,N2O4的含量降低。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,逆反应方向为吸热反应,所以 该反应的正反应为放热反应。△H<0。在温度不变时,增大压强,平衡正向移动,N2O4的含量增大。所以p1>p2.错误。D. 25℃时,等pH的NaOH溶液与氨水,由于NaOH为强碱,完全电离,而NH3·H2O是弱碱,部分电离,因此c(NH3·H2O)>c(NaOH).当稀释相同的倍数时,由于NH3·H2O会继续电离产生OH-。因此溶液的pH变化较小。因此其中曲线a对应氨水。正确。


科目:高中化学 来源: 题型:
【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
|
|
| 产生黄绿色气体 |
|
| 溶液变蓝 | |
|
| 溶液变红 | |
|
| 产生白色沉淀 | |
下列判断不正确的是![]()
![]()
A.实验![]() 中发生的主要反应是
中发生的主要反应是![]()
B.实验![]() 中发生的主要反应是
中发生的主要反应是![]()
C.实验![]() 中该条件下氧化性强弱
中该条件下氧化性强弱![]()
D.实验![]() 中
中![]() 与
与![]() 相互促进水解
相互促进水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe3++SO32-+H2O![]() 2Fe2++SO42-+2H+,如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,A是灵敏电流表,其指针总是偏向电源负极,A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是( )
2Fe2++SO42-+2H+,如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,A是灵敏电流表,其指针总是偏向电源负极,A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是( )
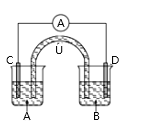
A.A指针向右偏转
B.U中阳离子向左烧杯移动
C.一段时间后,化学反应达到平衡状态,导线中无电流通过
D.一段时间后,右烧杯中溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
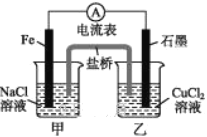
(1)如图所示为某实验小组设计的原电池装置,依据的氧化还原为(用离子反应方程式表示)_____________________________________。
反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过_____mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________,这是由于NH4Cl溶液显____(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因:_____________________,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式:_________________________________________。
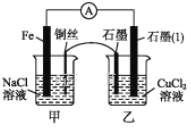
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞溶液,现象是________________,电极反应为_________________________;乙装置中石墨(1)为____(填“正”“负”“阴”或“阳”)极,乙装置中与铜丝相连石墨电极上发生的反应式为________________,产物常用___________________ 检验,反应的离子方程式为 _____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,Fe与水并不发生反应,但在高温下,Fe与水蒸气可发生反应。高温下Fe与水蒸气的反应实验应使用如图所示的装置,在硬质玻璃管中放入铁粉和石棉绒的混合物,通入水蒸气并加热。请回答实验的相关问题。
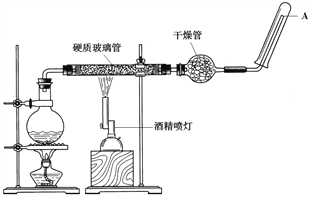
(1)该反应的反应方程式为_________。
(2)圆底烧瓶中装的是水,该装置的主要作用是______________;烧瓶底部放了几片碎瓷片,碎瓷片的作用是________________________。
(3)干燥管中盛装的物质是____________,作用是________________________。
(4)如果要在A处玻璃管口点燃该气体,则必须对该气体进行____________,方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列操作会引起测定结果偏高的是
①滴定时,装待测溶液的锥形瓶有少量水
②酸式滴定管用蒸馏水洗后,未用标准溶液洗
③滴定终点读数时,仰视
④量取氢氧化钠溶液时,量取前有气泡,量取后气泡消失
A.③B.②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用未知浓度NaOH溶液滴定标准醋酸溶液,其pH变化曲线如图,则下列说法正确的是( )
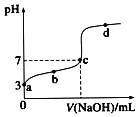
A.醋酸溶液浓度为![]()
B.滴定过程中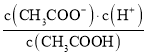 逐渐减小
逐渐减小
C.a、b、c三点溶液的导电能力逐渐减小
D.C点处溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①已知t℃时AgCl的Ksp=2×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A.在t℃时,Ag2CrO4的Ksp为1×10-9
B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C.在t℃时,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/L KCl和0.01 mol/L的K2CrO4的混和溶液,CrO42-先沉淀
D.在t℃时,反应Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:锂硫电池的总反应为2Li+xS===Li2Sx。以锂硫电池为电源,通过电解含(NH4)2SO4 的废水制备硫酸和化肥的示意图如图 (不考虑其他杂质离子的反应)。下列说法正确的是

A. b为电源的正极
B. 每消耗32 g硫,理论上导线中一定通过2 mol e-
C. SO42-通过阴膜由原料室移向M室
D. N室的电极反应式为2H2O-4e-===O2↑+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com