
【题目】用未知浓度NaOH溶液滴定标准醋酸溶液,其pH变化曲线如图,则下列说法正确的是( )
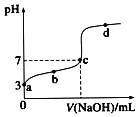
A.醋酸溶液浓度为![]()
B.滴定过程中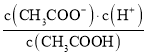 逐渐减小
逐渐减小
C.a、b、c三点溶液的导电能力逐渐减小
D.C点处溶液中![]()
科目:高中化学 来源: 题型:
【题目】材料是人类赖以生存和发展的重要物质基础,回答下列问题:
(1)下列生产工艺能获取新型无机非金属材料的是 ______ (填序号)。
①采用甲烷为原料,在微波和其他条件下生产金刚石
②采用传统方法用焦炭还原SiO2制备单晶硅
③在水泥生产过程中加入高炉矿渣生产特殊用途的水泥
④在玻璃生产过程中加入K、Pb生产其有特殊用途的光学玻璃
(2)某炼铁高炉中一次投入磁铁矿冶炼生铁,若该过程中转移的电子为1.60×105mol,不考虑其他的反应,也不考虑生铁中的杂质,则炼得的生铁为 ______t。生铁中含碳、硫等元素较多,炼钢是以生铁为原料,除去过多的碳、硫等杂质元素,其中除去硫的化学方程式为 ______。
(3)工业炼金属Al的工艺流程如下:

该工艺中冰晶石和氟化钙的作用是 ______,物质W的化学式为 ______ ;若铝土矿的纯度为60%,提取W的损失率为3%,电解时损失率为0.1%,粗铝净化时的损失率为2%,铝锭中铝的含量为99.9%,那么1.0t铝土矿可制备铝锭 ______t。
(4)金属腐蚀带来的损失无法估量。钢铁腐蚀多为吸氧腐蚀,其正极反应式为 ______,金属防腐措施很多,其中牺牲阳极(金属Zn)的阴极保护法的“阴极”反应式为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液仅含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的4种离子,所含离子的物质的量均为
中的4种离子,所含离子的物质的量均为![]() 。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法错误的是( )
。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法错误的是( )
A.该溶液中所含的离子是:![]() 、
、![]() 、
、![]() 、
、![]()
B.若向该溶液中加入过量的稀硫酸和![]() 溶液,溶液显血红色
溶液,溶液显血红色
C.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
D.若向该溶液中加入足量的![]() 溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为
溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图像的叙述正确的是
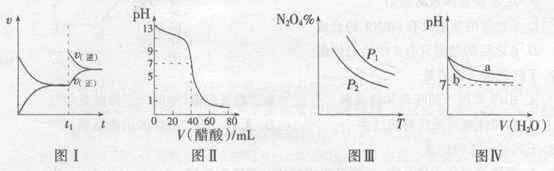
A.图I表示:反应I2(g)+H2(g) ![]() 2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
B.图Ⅱ表示:25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液的滴定曲线,其中c(CH3COOH)=0.1000mol/L
C.图Ⅲ表示:反应2NO2(g) ![]() N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
D.图Ⅳ表示:25℃时,分别稀释等体积,等pH的NaOH溶液与氨水时的pH变化,其中曲线a对应氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+H2O![]() HClO+H++Cl- K2=10-3.4
HClO+H++Cl- K2=10-3.4
HClO![]() H++ClO- Ka=?
H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )
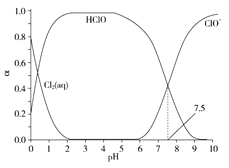
A.Cl2(g)+H2O![]() 2H++ClO-+Cl- K=10-10.9
2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,3.4g NH3含N—H 键0.2 NA
B.标准状况下,1.4g N2、CO混合气体体积约为1.12 L
C.常温常压下,100 mL 0.1mol·L—1的过氧化氢水溶液中含氢原子的数目为0.02 NA
D.常温常压下,0.1 mol·L-1CH3COONa溶液中,c(CH3COO—)小于0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2 mol氧原子中含1.6NA个电子
B.1 mol 氯化镁中含有离子数为NA
C.12.4 g白磷中含有磷原子数为0.1NA
D.28 g一氧化碳气体所含的电子数为20NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com