
【题目】下表是元素周期表的一部分,请回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | H | ||||||
2 | C | ||||||
3 | Na | Mg | P | S | Cl |
(1)周期表中第三周期第ⅡA族的元素是_____。
(2)P、S、Cl三种元素中,非金属性最强的是____(填元素符号)。
(3)钠元素最高价氧化物对应水化物的化学式是____,常温下该水化物溶液的pH____(填“>”“<”或“=”)7。
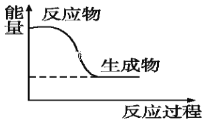
(4)如图为木炭在氧气中燃烧的能量变化图,此反应为____(填“放热”或“吸热”)反应。
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌.某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为_____________;
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_____________操作。
(3)浸出液“净化”过程中加入的主要物质为_____________,其作用是_______。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是_____________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaClO溶液吸收NO尾气,可提高尾气中NO的去除率。其他条件相同时,NO(转化为![]() )的转化率随NaClO溶液初始pH用稀硫酸调节
)的转化率随NaClO溶液初始pH用稀硫酸调节![]() 的变化如图所示。下列说法正确的是
的变化如图所示。下列说法正确的是
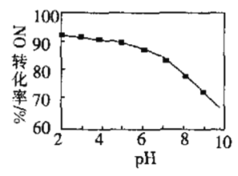
A.HClO氧气NO的能力比NaClO强
B.向NaClO溶液中通入NO后,溶液pH增大
C.若要吸收4.48LNO,则消耗3molNaClO
D.NaClO溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,甲、乙两池中均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始时先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流表指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是( )

A. 闭合K1,断开K2后,A电极增重
B. 闭合K1,断开K2后,乙池溶液浓度上升
C. 断开K1,闭合K2后,A电极发生氧化反应
D. 断开K1,闭合K2后,NO![]() 向B电极移动
向B电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
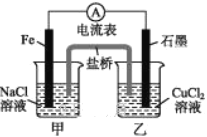
(1)如图所示为某实验小组设计的原电池装置,依据的氧化还原为(用离子反应方程式表示)_____________________________________。
反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过_____mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________,这是由于NH4Cl溶液显____(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因:_____________________,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式:_________________________________________。
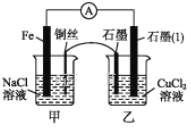
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞溶液,现象是________________,电极反应为_________________________;乙装置中石墨(1)为____(填“正”“负”“阴”或“阳”)极,乙装置中与铜丝相连石墨电极上发生的反应式为________________,产物常用___________________ 检验,反应的离子方程式为 _____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)
A.酸式滴定管未用标准盐酸润洗
B.滴定过程中不慎有液体溅出
C.滴定前仰视读数,滴定后读数正确
D.碱式滴定管未用待测液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列操作会引起测定结果偏高的是
①滴定时,装待测溶液的锥形瓶有少量水
②酸式滴定管用蒸馏水洗后,未用标准溶液洗
③滴定终点读数时,仰视
④量取氢氧化钠溶液时,量取前有气泡,量取后气泡消失
A.③B.②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)常温时,0.1molL-1NH4Al(SO4)2溶液的pH=3。
①溶液的Kw=______(填数值),由水电离的c(H+)=_____molL-1。
②溶液中c(NH4+)+c(NH3H2O)_____c(Al3+)+c(Al(OH)3)(填>”“=”“<”);
2c(SO42-)﹣c(NH4+)﹣3c(Al3+)=_______molL-1(计算式);
(2)80℃时,0.1molL-1NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是______;
(3)常温时,向100mL0.1molL-1NH4HSO4溶液中滴加0.1molL-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。
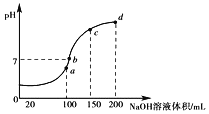
①图中a、b、c、d四个点中水的电离程度最小的是______。
②向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为______。
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是_____。
(4)NH4Al(SO4)2可做净水剂,写出工业制金属铝的化学方程式______;
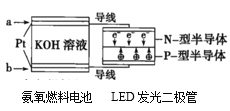
(5)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。电池反应为4NH3+3O2=2N2+6H2O;请写出通入a气体一极的电极反应式为______;每消耗3.4gNH3转移电子的物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图1表示用相同浓度的NaOH溶液分别滴定浓度相同的3种一元酸,由图可确定酸性最强的是____(填“①”、“②“或“③”)。如图2表示用相同浓度的硝酸银标准溶液分别滴定浓度相同的含Cl-、Br-及I-的混合溶液,由图可确定首先沉淀的离子是 _____。
图1  图2
图2 
(2)25℃时,Ksp(AgCl)=1.8×10-10,若向1L0.1mol·L-1的NaCl溶液中加入1L0.2mol·L-1的硝酸银溶液,充分反应后溶液中c(Cl-)=________(不考虑混合后溶液体积的变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com