
【题目】用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)
A.酸式滴定管未用标准盐酸润洗
B.滴定过程中不慎有液体溅出
C.滴定前仰视读数,滴定后读数正确
D.碱式滴定管未用待测液润洗
【答案】D
【解析】
A.酸式滴定管未用待测盐酸润洗,则酸液被稀释,若碱往酸中滴,造成消耗的V(碱)偏小,根据c(碱)=![]() 分析,可知c(碱)偏大;若酸往碱中滴,造成消耗的V(酸)偏大,根据c(碱)=
分析,可知c(碱)偏大;若酸往碱中滴,造成消耗的V(酸)偏大,根据c(碱)=![]() 分析,可知c(碱)偏大,A错误;
分析,可知c(碱)偏大,A错误;
B.滴定过程中锥形瓶中不慎有液体溅出,若碱往酸中滴,造成消耗的V(碱)偏小,根据c(碱)=![]() 分析,可知c(碱)偏大;若酸往碱中滴,造成消耗的V(酸)偏小,根据c(碱)=
分析,可知c(碱)偏大;若酸往碱中滴,造成消耗的V(酸)偏小,根据c(碱)=![]() 分析,可知c(碱)偏小,B错误;
分析,可知c(碱)偏小,B错误;
C.滴定前仰视读数,滴定后读数正确,若碱往酸中滴,导致的V(碱)偏小,根据c(碱)=![]() 分析,可知c(碱)偏大;若酸往碱中滴,造成消耗的V(酸)偏小,根据c(碱)=
分析,可知c(碱)偏大;若酸往碱中滴,造成消耗的V(酸)偏小,根据c(碱)=![]() 分析,可知c(碱)偏小,C错误;
分析,可知c(碱)偏小,C错误;
D.碱式滴定管未用待测液润洗,碱被稀释,浓度偏小,若碱往酸中滴,造成消耗的V(碱)偏大,根据c(碱)=![]() 分析,可知c(碱)偏小;若酸往碱中滴,造成消耗的V(酸)偏小,根据c(碱)=
分析,可知c(碱)偏小;若酸往碱中滴,造成消耗的V(酸)偏小,根据c(碱)=![]() 分析,可知c(碱)偏小,D正确;
分析,可知c(碱)偏小,D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是 ( )
A. CH4 + Cl2![]() CH3Cl + HCl
CH3Cl + HCl
B. 2CH3CH3+5O2![]() 2CO2+6H2O
2CO2+6H2O
C. ![]()
D. 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应2HI(g)![]() H2(g)+ I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深,可采取的措施是: ①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强
H2(g)+ I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深,可采取的措施是: ①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强
A. ①③⑥ B. ③⑤⑥ C. ①③⑤ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,能说明可逆反应A(s)+3B(g)![]() 2C(g)达到平衡状态的是( )
2C(g)达到平衡状态的是( )
①C的生成速率与C的分解速率相等
②单位时间内生成a mol A,同时生成3a mol B
③气体密度不再变化
④混合气体的总压强不再变化
⑤A、B、C的物质的量之比为1:3:2
⑥混合气体的总物质的量不再改变
A.②④⑤⑥B.①③④⑥C.①②④⑥D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.测定溶液的pH时,应先将pH试纸润湿,然后进行检测
B.为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次混合溶液的pH
C.常温下若强酸强碱等体积中和后![]() ,则中和之前
,则中和之前![]()
D.在![]() 的某溶液中,水电离出的
的某溶液中,水电离出的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。
I.请根据下表中短周期元素的原子半径和主要化合价,回答表后问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)元素①在周期表中的位置为________。
(2)元素①、⑦的氢化物的稳定性由强到弱的顺序为_________(填化学式);
(3)元素①、③形成的18电子化合物的电子式为______;
(4)元素②、⑧的最高价氧化物对应的水化物中,碱性较强的是______(填化学式);
(5)元素⑤、⑧的最高价氧化物对应的水化物的水溶液反应的离子方程式为_________。
II.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(6)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。铅蓄电池放电时正极是__(填物质化学式)。若电解液体积为2L(
(7)甲醛(HCHO)燃料电池的工作原理如下图所示。

①该电池工作时,b口通入的物质为________;
②该电池工作时,电子的流向为___________(填“从左到右”或“从右到左”);
③右侧电极的电极反应方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统的生物脱氮主要包括有氧条件下的硝化反应过程和缺氧环境下的反硝化反应过程,其工艺如下图所示。硝化过程中,![]() 先后被氧化为
先后被氧化为![]() 和
和![]() 。
。![]() 硝化过程中会使溶液酸度提高,需要加入NaHCO3进行中和;反硝化反应过程中,加入碳源(甲醇等有机物)将硝化反应中生成的
硝化过程中会使溶液酸度提高,需要加入NaHCO3进行中和;反硝化反应过程中,加入碳源(甲醇等有机物)将硝化反应中生成的![]() 和
和![]() 还原为N2,如:5CH3OH +6
还原为N2,如:5CH3OH +6![]() = 3N2↑+5CO2+7H2O+6OH-
= 3N2↑+5CO2+7H2O+6OH-
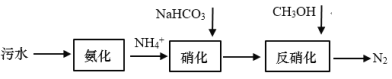
(1)请写出![]() 硝化生成
硝化生成![]() 的离子方程式:________。
的离子方程式:________。
(2)若1mol![]() 继续被氧化为
继续被氧化为![]() ,需消耗O2____L。(标准状况)
,需消耗O2____L。(标准状况)
(3)现在很多国家采用半硝化工艺(ANAMMOX) ,工作原理如下图所示:
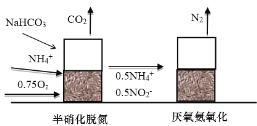
①写出厌氧氨氧化时![]() 与
与![]() 发生反应的离子方程式______。
发生反应的离子方程式______。
②若采用该方法,请判断是否需要加入碳源(甲醇),并简述理由______。
(4)研究发现,脱氮工艺常会产生一种温室气体N2O,目前普遍认为形成于硝化阶段,则生成N2O的可能原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是化学课外活动小组设计的用化学电源(锌铜硫酸原电池)使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )

A.铜片为负极B.锌片上发生还原反应
C.其能量转化的形式主要是“化学能→电能→光能”D.如果将稀硫酸换成盐酸,LED灯将不会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t ℃时AgCl的Ksp=4×10-10,在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
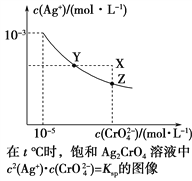
A. 在t ℃时,Ag2CrO4的Ksp为1×10-11
B. 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点
C. 在t ℃,Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)平衡常数K=6.25×107
(aq)平衡常数K=6.25×107
D. 在t ℃时,以0.001 mol·L-1 AgNO3溶液滴定20 mL 0.001 mol·L-1 KCl和0.001 mol·L-1的K2CrO4的混合溶液,CrO![]() 先沉淀
先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com