
【题目】NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)常温时,0.1molL-1NH4Al(SO4)2溶液的pH=3。
①溶液的Kw=______(填数值),由水电离的c(H+)=_____molL-1。
②溶液中c(NH4+)+c(NH3H2O)_____c(Al3+)+c(Al(OH)3)(填>”“=”“<”);
2c(SO42-)﹣c(NH4+)﹣3c(Al3+)=_______molL-1(计算式);
(2)80℃时,0.1molL-1NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是______;
(3)常温时,向100mL0.1molL-1NH4HSO4溶液中滴加0.1molL-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。
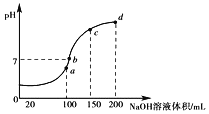
①图中a、b、c、d四个点中水的电离程度最小的是______。
②向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为______。
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是_____。
(4)NH4Al(SO4)2可做净水剂,写出工业制金属铝的化学方程式______;
(5)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。电池反应为4NH3+3O2=2N2+6H2O;请写出通入a气体一极的电极反应式为______;每消耗3.4gNH3转移电子的物质的量为______。
【答案】1.0×10-14 1.0×10-3 = 10-3﹣10-11 NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小 d H++OH-=H2O c(H+)>c(SO42-)>c(NH4+)>c(OH-) 2Al2O3![]() 4Al+3O2↑ 2NH3+6OH--6e-=N2+6H2O 0.6mol
4Al+3O2↑ 2NH3+6OH--6e-=N2+6H2O 0.6mol
【解析】
(1)①常温时,水的离子积常数为1.0×10-14;0.1molL-1![]() 溶液的pH=3是因为铵根离子和铝离子的水解;
溶液的pH=3是因为铵根离子和铝离子的水解;
②据物料守恒分析;根据电荷守恒计算;
(2)![]() 水解,升高温度其水解程度增大;
水解,升高温度其水解程度增大;
(3)①a、b、c、d四个点,根据反应量的关系,a点恰好消耗完![]() ,溶液中只有
,溶液中只有![]() 与
与![]() ;b、c、d三点溶液均含有
;b、c、d三点溶液均含有![]() ,
,![]() 可以促进水的电离,而
可以促进水的电离,而![]() 抑制水的电离,b点溶液呈中性;
抑制水的电离,b点溶液呈中性;
②向100mL 0.1molL-1![]() 溶液中滴加0.1molL-1
溶液中滴加0.1molL-1![]() 溶液100mL时,仅发生氢离子和氢氧根离子的中和反应;
溶液100mL时,仅发生氢离子和氢氧根离子的中和反应;
(4)工业上通过电解熔融的氧化铝制金属铝;
(5)根据电子运动方向,判断a为负极,写出电极反应式并计算转移电子数。
(1)①常温时,水的离子积常数为l.0×l014;0.1molL1![]() 溶液的pH=3是因为铵根离子和铝离子的水解,所以由水电离的
溶液的pH=3是因为铵根离子和铝离子的水解,所以由水电离的![]() ,
,
故答案为:1.0×10-14;1.0×10-3;
②据物料守恒,![]() 中
中![]() 原子与
原子与![]() 原子个数比为1:1,所以
原子个数比为1:1,所以![]() ;根据电荷守恒得
;根据电荷守恒得![]()
故答案为:=;1031011;
(2) ![]() 水解,升高温度其水解程度增大,pH减小,
水解,升高温度其水解程度增大,pH减小,
故答案为:![]() 水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
(3)①a、b、c、d四个点,根据反应量的关系,a点恰好消耗完![]() ,溶液中只有
,溶液中只有![]() 与
与![]() ;b、c、d三点溶液均含有
;b、c、d三点溶液均含有![]() ,
,![]() 可以促进水的电离,而
可以促进水的电离,而![]() 抑制水的电离,所以d点水的电离程度最小,故答案为:d;
抑制水的电离,所以d点水的电离程度最小,故答案为:d;
②向100mL 0.1molL-1![]() 溶液中滴加0.1molL-1
溶液中滴加0.1molL-1![]() 溶液100mL时,仅发生氢离子和氢氧根离子的中和反应,离子方程式为
溶液100mL时,仅发生氢离子和氢氧根离子的中和反应,离子方程式为![]() ,
,
故答案为:![]() ;
;
③![]() 的电离方程式为
的电离方程式为![]() ,还有水的微弱电离,铵根离子因水解导致浓度略有减小,所以离子浓度由大到小的顺序为
,还有水的微弱电离,铵根离子因水解导致浓度略有减小,所以离子浓度由大到小的顺序为![]() ,故答案为:
,故答案为:![]() ;
;
(4)工业上通过电解熔融的氧化铝制金属铝,方程式为:![]() ,
,
故答案为:![]() ;
;
(5)根据电子运动方向,判断a为负极,氨气发生氧化反应生成氮气,电极反应式为:![]() ;根据电极反应式,2个氨气转移6个电子,故3.4g氨气即0.2mol氨气,转移0.6mol电子,
;根据电极反应式,2个氨气转移6个电子,故3.4g氨气即0.2mol氨气,转移0.6mol电子,
答案为:![]() ;0.6mol。
;0.6mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)请写出过量铁粉与稀硝酸反应的离子方程式 ______ ; 在标准状况下,当生成2.24LNO气体时,转移电子的物质的量为 ______ mol,有 ______ mol氧化剂被还原.
(2)将MnO4-氧化Fe2+的离子方程式补充完整:______________ MnO4-+ ______ Fe2++ ______ =Mn2++ ______ Fe3++ ______。
(3)完成“氧化除铁”步骤中反应的离子方程式: __________________ Fe(OH)2+ ______ ClO-+ ______ ![]() ______ Fe(OH)3+ ______Cl-。
______ Fe(OH)3+ ______Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | H | ||||||
2 | C | ||||||
3 | Na | Mg | P | S | Cl |
(1)周期表中第三周期第ⅡA族的元素是_____。
(2)P、S、Cl三种元素中,非金属性最强的是____(填元素符号)。
(3)钠元素最高价氧化物对应水化物的化学式是____,常温下该水化物溶液的pH____(填“>”“<”或“=”)7。
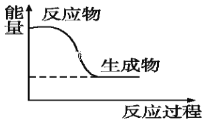
(4)如图为木炭在氧气中燃烧的能量变化图,此反应为____(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列结论中正确的是( )
A.稀释醋酸钠溶液,CH3COO-的水解程度变大,故溶液的pH变大
B.常温下Ka=1×10-5的浓度为0.1mol·L-1的HA溶液,其pH≈3
C.c(SO32-)相等的Na2SO3溶液、NaHSO3溶液、H2SO3溶液的浓度:c(NaHSO3)>c(H2SO3)>c(Na2SO3)
D.25℃时,向10mL0.01mol·L-1KOH溶液中滴加10mL0.01mol·L-1醋酸所得混合溶液中:c(K+)=c(CH3COO-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+H2O![]() HClO+H++Cl- K2=10-3.4
HClO+H++Cl- K2=10-3.4
HClO![]() H++ClO- Ka=?
H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )
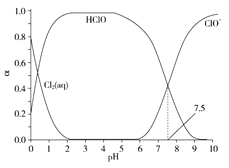
A.Cl2(g)+H2O![]() 2H++ClO-+Cl- K=10-10.9
2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作对应的现象与结论均正确的是( )
实验操作 | 现象 | 结论 | |
A | 常温下将 | 烧杯壁变凉 |
|
B | 向两支分别盛有 | 两支试管都有气泡产生 | 醋酸和硼酸的酸性比碳酸强 |
C | 将 | pH减小 | 稀释后 |
D | 常温下向物质的量浓度均为 | 先出现黄色沉淀 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。
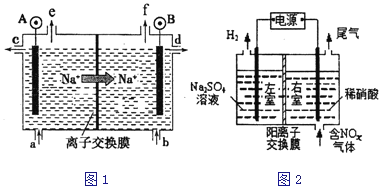
(1)电解食盐水是氯碱工业的基础.目前比较先进的方法是阳离子交换膜法,电解示意图如图1所示,图中的阳离子交换膜只允许阳离子通过,请回答以下问题:
①电解池实现了_______能向_______能的转化;
②图中A极要连接电源的__________(填“正”或“负”)极;
③电解总反应的化学方程式是______________________。
(2)电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图2所示(图中电极均为石墨电极),若用NO2气体进行模拟电解法吸收实验,写出电解时NO2发生的电极反应_______________________。
(3)在实际生产中,可在铁件的表面上镀铜防止铁被腐蚀,装置示意图如下甲图:
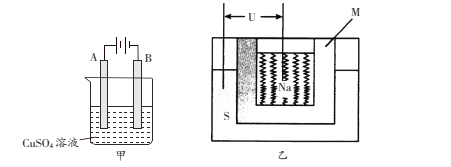
①电镀时,镀件与电源的____极连接,
②B电极上的电极反应是________________。
③乙图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx。用该电池作电源进行上述铁件镀铜时,若电镀池中两电极的质量开始相同,电镀完成后取出洗净、烘干、称量,二者质量差为25.6g,则理论上该电池负极消耗的质量为___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com