
����Ŀ�����ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�á�
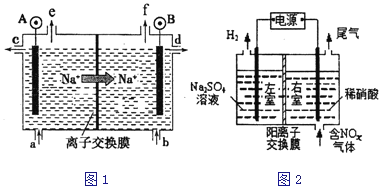
��1�����ʳ��ˮ���ȼҵ�Ļ�����Ŀǰ�Ƚ��Ƚ��ķ����������ӽ���Ĥ�������ʾ��ͼ��ͼ1��ʾ��ͼ�е������ӽ���Ĥֻ����������ͨ������ش��������⣺
�ٵ���ʵ����_______����_______�ܵ�ת����
��ͼ��A��Ҫ���ӵ�Դ��__________������������������������
�۵���ܷ�Ӧ�Ļ�ѧ����ʽ��______________________��
��2����ⷨ��������������������ɻ������ᣬ���нϸߵĻ���Ч��;���Ч�档ʵ����ģ���ⷨ����NOx��װ����ͼ2��ʾ��ͼ�е缫��Ϊʯī�缫��������NO2�������ģ���ⷨ����ʵ�飬д�����ʱNO2�����ĵ缫��Ӧ_______________________��
��3����ʵ�������У����������ı����϶�ͭ��ֹ������ʴ��װ��ʾ��ͼ���¼�ͼ��
�ٵ��ʱ���Ƽ����Դ��____�����ӣ�
��B�缫�ϵĵ缫��Ӧ��________________��
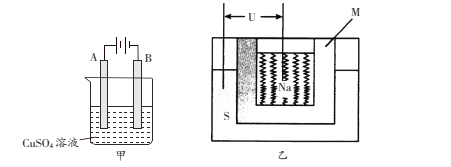
����ͼ��һ��������ܵ�صĽṹʾ��ͼ��M��Na2O��Al2O3�Ƶã��������ǵ����Ĥ���õ�ط�ӦΪ2Na+xS=Na2Sx���øõ������Դ��������������ͭʱ������Ƴ������缫��������ʼ��ͬ�������ɺ�ȡ��ϴ������ɡ�����������������Ϊ25.6g���������ϸõ�ظ������ĵ�����Ϊ___________g��
���𰸡��� ��ѧ �� 2Cl-+2H2O![]() Cl2��+H2��+2OH- NO2-e-+H2O=NO3-+2H+�� ���� Cu2++2e-=Cu; 9.2g
Cl2��+H2��+2OH- NO2-e-+H2O=NO3-+2H+�� ���� Cu2++2e-=Cu; 9.2g
��������
��1�����ݵ������������������ƶ������жϵ�ص���������
��2���������Ҳ�������������ԭ��Ӧ���������жϳ�����Ϊ�����ң�����Ϊ�����ң�������ɵ缫��Ӧʽ����д��
��3������������·�е����غ���м��㸺�������Ƶ�������
��1���ٵ����ǰѵ���ת��Ϊ��ѧ�ܵ�װ�ã����Դ𰸣��磻��ѧ��
���ɵ��ʳ��ˮװ��ͼ��֪�������������ұߣ��������AΪ����������A��Ҫ���ӵ�Դ���������ʴ�Ϊ:��;
���ɵ��ʳ��ˮװ��ͼ��֪�������������ұߣ������AΪ�������ұ�BΪ����������Ȼ�����Һ���ܷ�Ӧ���ӷ���ʽΪ��2Cl-+2H2O![]() Cl2��+H2��+2OH-
Cl2��+H2��+2OH-
��2���ٸ���ͼ֪�����ʱ�������е缫�������ӷŵ�����������������Ϊ������,����Ϊ
������,������ͨ����ǵ���������ɵ����ᣬ���������ϵ�������ʧ���Ӻ�ˮ��������,�缫��ӦʽΪ:NO2-e-+H2O=NO3-+2H+�ʴ�Ϊ: NO2-e-+H2O=NO3-+2H+��
��3�����������ı����ͭ���Ʋ����ͭ��������������A��Ӧ�Ľ���������ͭ���Ƽ������������ʶƼ���������Դ�ĸ��������Դ𰸣�������
���������Ϸŵ���ǵ������Һ�е�ͭ���ӣ��õ��ӷ�����ԭ��Ӧ���䷴Ӧ�ĵ缫ʽΪ:Cu2++2e-=Cu;�𰸣�Cu2++2e-=Cu;
��ԭ����ܷ�ӦΪ��2Na+xS=Na2Sx�У����ʱ���Ʋ����������Ƽ�������������������ͭʧ���ӷ���������Ӧ���缫��ӦʽΪCu-2e-=Cu2+��������ͭ���ӵõ��ӷ�����ԭ��Ӧ��������ӦʽΪCu2++2e-=Cu;��ƺ������缫��������������ܽ�������������������֮�ͣ������ǰ����ͭ���缫��������ͬ�������ɺ�����ȡ��ϴ������ɡ�����������������Ϊ25.6g , ���������ܽ�ͭ������Ϊ12.8g������ͭ�����ʵ���Ϊ0.2mol��ת�Ƶĵ���Ϊ0.4mol����������Ƴصĵ缫�ĵ��ӵ����ʵ���Ϊ0.4mol����������Ƴصĵ��ӵ���������ԭ������������ĵ��ӵ�����ͬ����ԭ��ظ����ϱ����ĵ������ʵ�������ת�Ƶĵ��ӵ����ʵ���������Ҫת��0.4mol���ӣ���Ҫ����0.4mol Na��������Ϊ0.4mol ![]() 23g/mol=9.2g���𰸣�9.2g��
23g/mol=9.2g���𰸣�9.2g��


 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ�ý���ʵ�飬�ס��������о�Ϊ1 mol��L��1��AgNO3��Һ��A��B��ΪAg�缫��ʵ�鿪ʼʱ�ȱպ�K1���Ͽ�K2��һ��ʱ��Ͽ�K1���պ�K2���γ�Ũ���أ�������ָ��ƫת(Ag��Ũ��Խ��������Խǿ)������˵������ȷ����(����)

A. �պ�K1���Ͽ�K2��A�缫����
B. �պ�K1���Ͽ�K2���ҳ���ҺŨ������
C. �Ͽ�K1���պ�K2��A�缫����������Ӧ
D. �Ͽ�K1���պ�K2��NO![]() ��B�缫�ƶ�
��B�缫�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al(SO4)2��NH4HSO4�ڷ����Լ���ҽҩ�����ӹ�ҵ����;�㷺����ش��������⣺
��1������ʱ��0.1molL-1NH4Al(SO4)2��Һ��pH��3��
����Һ��Kw=______������ֵ������ˮ�����c(H+)=_____molL-1��
����Һ��c(NH4+)+c(NH3H2O)_____c(Al3+)+c(Al(OH)3)���������������������
2c(SO42-)��c(NH4+)��3c(Al3+)��_______molL-1������ʽ����
��2��80��ʱ��0.1molL-1NH4Al(SO4)2��Һ��pHС��3����������pH���¶ȱ仯��ԭ����______��
��3������ʱ����100mL0.1molL-1NH4HSO4��Һ�еμ�0.1molL-1NaOH��Һ���õ���ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ��ʾ��
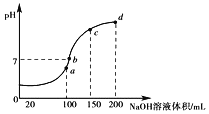
��ͼ��a��b��c��d�ĸ�����ˮ�ĵ���̶���С����______��
����NH4HSO4��Һ�еμ�NaOH��Һ��a��Ĺ����У�������Ӧ�����ӷ���ʽΪ______��
��NH4HSO4��Һ�и�����Ũ���ɴ�С������˳����_____��
��4��NH4Al(SO4)2������ˮ����д����ҵ�ƽ������Ļ�ѧ����ʽ______��
��5��һ�ְ�ȼ�ϵ�أ�ʹ�õĵ������Һ��2mol/L��KOH��Һ����ط�ӦΪ4NH3+3O2=2N2+6H2O����д��ͨ��a����һ���ĵ缫��ӦʽΪ______��ÿ����3.4gNH3ת�Ƶ��ӵ����ʵ���Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͪ��![]() ������������������Ҫ����;������������Һ���û�������ӵ���������Ʊ�����ԭ������ͼ��ʾ������˵����ȷ����
������������������Ҫ����;������������Һ���û�������ӵ���������Ʊ�����ԭ������ͼ��ʾ������˵����ȷ����
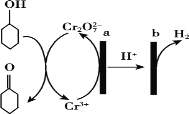
A.a�����Դ��������
B.a���缫��Ӧʽ��2Cr3++7H2O ��6e-=Cr2O72-+14H+
C.b������������Ӧ
D.��������1mol����ͪ����ʱ����2mol�����ų�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 L���ܱ������г���2 molX(g)��1 mol Y��g��,������Ӧ2X(g) +Y(g) ![]() 3Z(g) ��H����Ӧ�����г��������¶ȣ���û����ϵ��X������������¶ȵĹ�ϵ��ͼ��ʾ�������ƶ���ȷ����
3Z(g) ��H����Ӧ�����г��������¶ȣ���û����ϵ��X������������¶ȵĹ�ϵ��ͼ��ʾ�������ƶ���ȷ����

A.�����¶�.ƽ�ⳣ������
B.W��Y������Ӧ���ʵ���M��Y������Ӧ����
C.Q��ʱ,Y��ת�������
D.ƽ��ʱ����3molZ,�ﵽ��ƽ��ʱZ�����������ԭƽ��ʱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͼ1��ʾ����ͬŨ�ȵ�NaOH��Һ�ֱ�ζ�Ũ����ͬ��3��һԪ�ᣬ��ͼ��ȷ��������ǿ����____�������١������ڡ������ۡ�������ͼ2��ʾ����ͬŨ�ȵ�����������Һ�ֱ�ζ�Ũ����ͬ�ĺ�Cl����Br����I���Ļ����Һ����ͼ��ȷ�����ȳ����������� _____��
ͼ1  ͼ2
ͼ2 
��2��25��ʱ��Ksp(AgCl)��1.8��10-10������1L0.1mol��L-1��NaCl��Һ�м���1L0.2mol��L-1����������Һ����ַ�Ӧ����Һ��c��Cl-��=________�������ǻ�Ϻ���Һ����ı仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������Ŵ�����CN����Ʒ�ˮ�ķ�����ͼ(CN����CNO����N�Ļ��ϼ۾�Ϊ��3��)��
![]()
![]()
![]()
![]()
![]()
ijѧϰС��������������������ͼʵ��װ�ý��иõ�Ʒ�ˮ�������о���

�������裺
��.�ȹر�װ�üĿ��أ��ٽ���CN����ˮ�����NaClO��Һ��ϣ�ȡ200 mL���Һ[����c��CN-��=0.200mol/L]����װ�ü��У�������Ƥ����
��.��װ�ü��г�ַ�Ӧ���أ�ʹ��Һȫ������װ�����У��رտ��ء�
��.�ⶨ����������ӵ�������
(1)д��װ�����з�Ӧ�����ӷ���ʽ��________________________________________��
(2)װ�ñ��е��Լ���_______________��װ�ö���������_______________________��
(3)�ٶ�����ʵ���е����嶼��������ա��������������1.408 g����CN���������İٷ���Ϊ__________��
(4)����Ϊ�ô�װ�ý���ʵ�飬��(3)�Աȣ�CN���������İٷ��ʽ�________(����ƫ��������ƫ����������ȷ����������Ӱ����)������������ɣ�________________________________��
��.���ο�����Ⱦ,ȼú�������Ҫ��Ŀǰ��ѧ�Ҷ�Fe3����Һ���������о���ȡ���³ɹ���
(5)ijѧϰС��Ϊ��̽����SO2��Fe3����Ӧ�IJ���������������SO2ͨ��FeCl3��Һ�к�ȡ10 mL��ӦҺ�ֱ������ΪA��B��C���Թ��У����������3��ʵ�鷽����
��������A�м�������KMnO4��Һ����Һ�Ϻ�ɫ��ȥ��
��������B�м���KSCN��Һ����Һ����죬�ټ������Ƶ���ˮ����Һ��졣
��������C�м���ϡ�����ữ��BaCl2��Һ��������ɫ������
����ʵ�鷽���в���������________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��F��GΪ���ֳ��õ����ϣ��ɾ�����·����ȡ��

��ش��������⣺
(1)F�ķ���ʽΪ______��������C�����������ŵ�������______��_______��
(2)д�����з�Ӧ���̵ķ�Ӧ���ͣ���ϩ��F________��A��B_________��
(3)1molA��2molNaOH��Ӧ������ȥ��Ӧ�Ļ�ѧ����ʽΪ________________��Bת��ΪC�Ļ�ѧ����ʽΪ______________________________________��
(4)E��һ��ͬ���칹��M�����������ʣ����ܷ���������Ӧ����1mol M�������Ľ����Ʒ�Ӧ�ɲ���1mol H2����M�Ľṹ��ʽΪ_____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com