
【题目】环己酮(![]() )在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如下图所示。下列说法正确的是
)在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如下图所示。下列说法正确的是
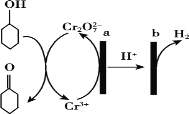
A.a极与电源负极相连
B.a极电极反应式是2Cr3++7H2O —6e-=Cr2O72-+14H+
C.b极发生氧化反应
D.理论上有1mol环己酮生成时,有2mol氢气放出
【答案】B
【解析】
根据装置图可知,a极为电解池的阳极,Cr3+失电子发生氧化反应,电极反应式是2Cr3++7H2O-6e-═Cr2O72-+14H+,b极为阴极,氢离子得电子发生还原反应,结合转移电子数相等计算,据此分析解答。
A.根据装置图可知,a极为电解池的阳极,则与电源正极相连,故A错误;
B.根据装置图可知,a极为电解池的阳极,Cr3+失电子发生氧化反应,电极反应式是2Cr3++7H2O-6e-═Cr2O72-+14H+,故B正确;
C.b极为阴极,氢离子得电子发生还原反应,故C错误;
D.理论上由环己醇(C6H12O)生成1mol环己酮(C6H10O)时,转移2mol电子,根据电子守恒可知阴极有1mol氢气放出,故D错误;
故选:B。


科目:高中化学 来源: 题型:
【题目】已知:还原性![]() ,氧化性
,氧化性![]() 在含3mol
在含3mol![]() 的溶液中逐滴加入
的溶液中逐滴加入![]() 溶液,加入
溶液,加入![]() 和析出
和析出![]() 的物质的量的关系曲线如图所示.则下列有关说法正确的是( )
的物质的量的关系曲线如图所示.则下列有关说法正确的是( )
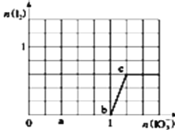
A.b点时的还原产物可能是![]()
B.当![]() 时,溶液中
时,溶液中![]()
C.a点时剩余![]() 的物质的量为
的物质的量为![]()
D.反应过程中的氧化反应所得产物均为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+H2O![]() HClO+H++Cl- K2=10-3.4
HClO+H++Cl- K2=10-3.4
HClO![]() H++ClO- Ka=?
H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )
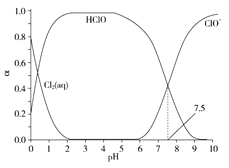
A.Cl2(g)+H2O![]() 2H++ClO-+Cl- K=10-10.9
2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,3.4g NH3含N—H 键0.2 NA
B.标准状况下,1.4g N2、CO混合气体体积约为1.12 L
C.常温常压下,100 mL 0.1mol·L—1的过氧化氢水溶液中含氢原子的数目为0.02 NA
D.常温常压下,0.1 mol·L-1CH3COONa溶液中,c(CH3COO—)小于0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。
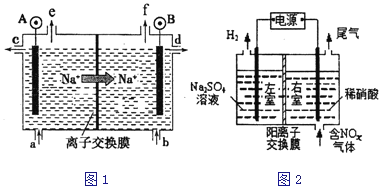
(1)电解食盐水是氯碱工业的基础.目前比较先进的方法是阳离子交换膜法,电解示意图如图1所示,图中的阳离子交换膜只允许阳离子通过,请回答以下问题:
①电解池实现了_______能向_______能的转化;
②图中A极要连接电源的__________(填“正”或“负”)极;
③电解总反应的化学方程式是______________________。
(2)电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图2所示(图中电极均为石墨电极),若用NO2气体进行模拟电解法吸收实验,写出电解时NO2发生的电极反应_______________________。
(3)在实际生产中,可在铁件的表面上镀铜防止铁被腐蚀,装置示意图如下甲图:
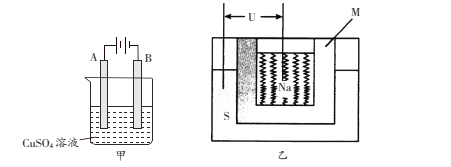
①电镀时,镀件与电源的____极连接,
②B电极上的电极反应是________________。
③乙图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx。用该电池作电源进行上述铁件镀铜时,若电镀池中两电极的质量开始相同,电镀完成后取出洗净、烘干、称量,二者质量差为25.6g,则理论上该电池负极消耗的质量为___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种降血压药物硝苯地平的合成路线如下:

已知:
 +R”’CHO
+R”’CHO
(1)A 的结构简式是 ___________。
(2)B与新制Cu(OH)2 反应的化学方程式是 ______________。
(3)H → I的反应类型是 _______________。
(4)试剂a 是 _______________。
(5)J→K的化学反应方程式是 ___________。
(6)F 有多种同分异构体,写出满足下列条件的一种同分异构体的结构简式__________。
①分子中含有酯基,且存在顺反异构
②能与金属Na单质反应,且能发生银镜反应
(7)1 mol 硝苯地平最多可与__________mol NaOH溶液发生水解反应。
(8)已知 D![]() E→F +CH3OH,E的结构简式是_______________。
E→F +CH3OH,E的结构简式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】珍爱生命,远离毒品.以下是四种毒品的结构简式,下列有关说法正确的是

A.四种毒品中都含有苯环,都属于芳香烃
B.K粉的化学式为C13H15ONCl
C.摇头丸经过消去反应、加成反应可制取冰毒
D.1mol大麻与溴水反应最多消耗4molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)

(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入_____,其目的是________________________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:______________________。
(3)在该实验中,若用1 mol乙醇和1 mol乙酸在浓硫酸作用下加热,充分反应,能否生成1 mol乙酸乙酯,为什么?__________________________________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
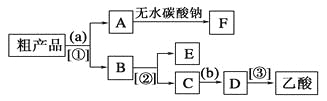
试剂a是__________,试剂b是__________;分离方法①是________,分离方法②是________,分离方法③是______。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com