
【题目】珍爱生命,远离毒品.以下是四种毒品的结构简式,下列有关说法正确的是

A.四种毒品中都含有苯环,都属于芳香烃
B.K粉的化学式为C13H15ONCl
C.摇头丸经过消去反应、加成反应可制取冰毒
D.1mol大麻与溴水反应最多消耗4molBr2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列操作会引起测定结果偏高的是
①滴定时,装待测溶液的锥形瓶有少量水
②酸式滴定管用蒸馏水洗后,未用标准溶液洗
③滴定终点读数时,仰视
④量取氢氧化钠溶液时,量取前有气泡,量取后气泡消失
A.③B.②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮(![]() )在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如下图所示。下列说法正确的是
)在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如下图所示。下列说法正确的是
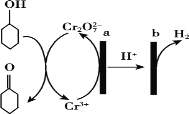
A.a极与电源负极相连
B.a极电极反应式是2Cr3++7H2O —6e-=Cr2O72-+14H+
C.b极发生氧化反应
D.理论上有1mol环己酮生成时,有2mol氢气放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图1表示用相同浓度的NaOH溶液分别滴定浓度相同的3种一元酸,由图可确定酸性最强的是____(填“①”、“②“或“③”)。如图2表示用相同浓度的硝酸银标准溶液分别滴定浓度相同的含Cl-、Br-及I-的混合溶液,由图可确定首先沉淀的离子是 _____。
图1  图2
图2 
(2)25℃时,Ksp(AgCl)=1.8×10-10,若向1L0.1mol·L-1的NaCl溶液中加入1L0.2mol·L-1的硝酸银溶液,充分反应后溶液中c(Cl-)=________(不考虑混合后溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:锂硫电池的总反应为2Li+xS===Li2Sx。以锂硫电池为电源,通过电解含(NH4)2SO4 的废水制备硫酸和化肥的示意图如图 (不考虑其他杂质离子的反应)。下列说法正确的是

A. b为电源的正极
B. 每消耗32 g硫,理论上导线中一定通过2 mol e-
C. SO42-通过阴膜由原料室移向M室
D. N室的电极反应式为2H2O-4e-===O2↑+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某环保部门处理含CN-电镀废水的方法如图(CN-和CNO-中N的化合价均为-3价):
![]()
![]()
![]()
![]()
![]()
某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究。

操作步骤:
ⅰ.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200 mL混合液[其中c(CN-)=0.200mol/L]加入装置甲中,塞上橡皮塞。
ⅱ.待装置甲中充分反应后,打开开关,使溶液全部流入装置乙中,关闭开关。
ⅲ.测定干燥管Ⅰ增加的质量。
(1)写出装置乙中反应的离子方程式:________________________________________。
(2)装置丙中的试剂是_______________,装置丁的作用是_______________________。
(3)假定上述实验中的气体都被充分吸收。若干燥管Ⅰ增重1.408 g。则CN-被处理的百分率为__________。
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将________(填“偏高”、“偏低”、“无法确定”或“无影响”),简述你的理由:________________________________。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10 mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去。
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
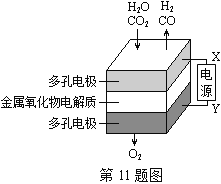
A. X是电源的负极
B. 阴极的反应式是:H2O+2eˉ=H2+O2ˉCO2+2eˉ=CO+O2ˉ
C. 总反应可表示为:H2O+CO2H2+CO+O2
D. 阴、阳两极生成的气体的物质的量之比是1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对电化学问题进行了实验探究。
Ⅰ.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。

(1)写出负极的电极反应式_______________。
(2)某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+
假设2:铁参与反应,被氧化生成Fe3+
假设3:____________。
(3)为了探究假设1、2,他采取如下操作:
①取0.01 mol·L-1FeCl3溶液2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变血红;
据②、③、④现象得出的结论是______________。
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施_________________。
Ⅱ.利用如图装置作电解50 mL 0.5 mol·L-1的CuCl2溶液实验。

实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO3-);
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:①________________;②___________。
(2)分析实验记录B中浅蓝色固体可能是____(写化学式),试分析生成该物质的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 的二元酸
的二元酸![]() 溶液中滴加
溶液中滴加![]() 溶液,溶液中含A元素的粒子的物质的量随NaOH溶液的体积变化如图,y点对应溶液的
溶液,溶液中含A元素的粒子的物质的量随NaOH溶液的体积变化如图,y点对应溶液的![]() 。下列说法中不正确的是
。下列说法中不正确的是 ![]()
![]()

A.二元酸![]() 的电离方程式为:
的电离方程式为:![]()
![]()
B.当溶液中![]() 和NaHA物质的量相等时:
和NaHA物质的量相等时:![]()
C.在x点溶液中离子浓度大小关系:![]()
D.常温下![]() 的电离常数为
的电离常数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com