
【题目】(1)如图1表示用相同浓度的NaOH溶液分别滴定浓度相同的3种一元酸,由图可确定酸性最强的是____(填“①”、“②“或“③”)。如图2表示用相同浓度的硝酸银标准溶液分别滴定浓度相同的含Cl-、Br-及I-的混合溶液,由图可确定首先沉淀的离子是 _____。
图1  图2
图2 
(2)25℃时,Ksp(AgCl)=1.8×10-10,若向1L0.1mol·L-1的NaCl溶液中加入1L0.2mol·L-1的硝酸银溶液,充分反应后溶液中c(Cl-)=________(不考虑混合后溶液体积的变化)。
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | H | ||||||
2 | C | ||||||
3 | Na | Mg | P | S | Cl |
(1)周期表中第三周期第ⅡA族的元素是_____。
(2)P、S、Cl三种元素中,非金属性最强的是____(填元素符号)。
(3)钠元素最高价氧化物对应水化物的化学式是____,常温下该水化物溶液的pH____(填“>”“<”或“=”)7。
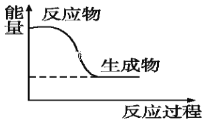
(4)如图为木炭在氧气中燃烧的能量变化图,此反应为____(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。
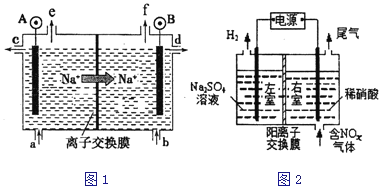
(1)电解食盐水是氯碱工业的基础.目前比较先进的方法是阳离子交换膜法,电解示意图如图1所示,图中的阳离子交换膜只允许阳离子通过,请回答以下问题:
①电解池实现了_______能向_______能的转化;
②图中A极要连接电源的__________(填“正”或“负”)极;
③电解总反应的化学方程式是______________________。
(2)电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图2所示(图中电极均为石墨电极),若用NO2气体进行模拟电解法吸收实验,写出电解时NO2发生的电极反应_______________________。
(3)在实际生产中,可在铁件的表面上镀铜防止铁被腐蚀,装置示意图如下甲图:
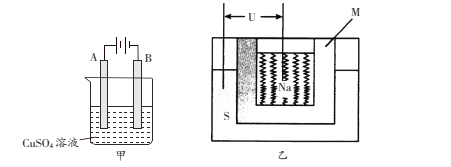
①电镀时,镀件与电源的____极连接,
②B电极上的电极反应是________________。
③乙图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx。用该电池作电源进行上述铁件镀铜时,若电镀池中两电极的质量开始相同,电镀完成后取出洗净、烘干、称量,二者质量差为25.6g,则理论上该电池负极消耗的质量为___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种降血压药物硝苯地平的合成路线如下:

已知:
 +R”’CHO
+R”’CHO
(1)A 的结构简式是 ___________。
(2)B与新制Cu(OH)2 反应的化学方程式是 ______________。
(3)H → I的反应类型是 _______________。
(4)试剂a 是 _______________。
(5)J→K的化学反应方程式是 ___________。
(6)F 有多种同分异构体,写出满足下列条件的一种同分异构体的结构简式__________。
①分子中含有酯基,且存在顺反异构
②能与金属Na单质反应,且能发生银镜反应
(7)1 mol 硝苯地平最多可与__________mol NaOH溶液发生水解反应。
(8)已知 D![]() E→F +CH3OH,E的结构简式是_______________。
E→F +CH3OH,E的结构简式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是
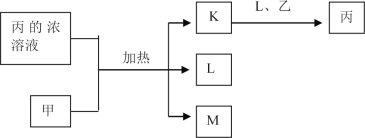
A. 原子半径:W<X<Y B. 元素的非全属性:Z>Y>X
C. 化合物XYZ中只含共价键 D. K、L、M中沸点最高的是M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】珍爱生命,远离毒品.以下是四种毒品的结构简式,下列有关说法正确的是

A.四种毒品中都含有苯环,都属于芳香烃
B.K粉的化学式为C13H15ONCl
C.摇头丸经过消去反应、加成反应可制取冰毒
D.1mol大麻与溴水反应最多消耗4molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、氮氧化物(NOx) 严重影响人们的生活和健康,化学工作者对氮氧化物的处理做了广泛而深人的研究。
I.利用甲烷还原NOX
①CH4(g)+4NO2(g)=4NO(g) +CO2(g)+2H2O(g) △H1=-574kJ/mol ;
②CH4 (g)+4NO(g)=2N2(g) +CO2(g)+2H2O(g) △H2=-1160 kJ/mol 。
(1)甲烷直接将NO2 还原为N2的热化学方程式为______________________________。
(2)在恒容(2L)密闭容器中充入1molCH4和2moINO2进行(1)中反应,CH4的平衡转化率φ。(CH4)与温度和压强的关系如图甲所示。
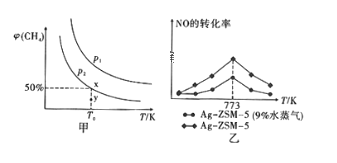
①若容器中的压强为p2,y 点; v 正________V逆(填“大于"“等于“或“小于”)。
②图中压强大小P1_______ P2
③X 点对应温度下反应的平衡常数K=______________ 。
II.某研究小组以Ag-ZSM-5为催化剂模拟汽车尾气的处理,实现NO和CO反应转化为无毒气体。同时利用反应放出的热量预热NO 和CO。实验测得NO的转化率随温度的变化如图乙所示。
(1)高于773K,NO的转化率降低的可能原因是_________________。
(2)为提高汽车尾气中NO的转化率,除了改变温度、压强外,还可以采取的措施有_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com