
【题目】已知:还原性![]() ,氧化性
,氧化性![]() 在含3mol
在含3mol![]() 的溶液中逐滴加入
的溶液中逐滴加入![]() 溶液,加入
溶液,加入![]() 和析出
和析出![]() 的物质的量的关系曲线如图所示.则下列有关说法正确的是( )
的物质的量的关系曲线如图所示.则下列有关说法正确的是( )
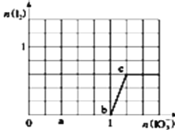
A.b点时的还原产物可能是![]()
B.当![]() 时,溶液中
时,溶液中![]()
C.a点时剩余![]() 的物质的量为
的物质的量为![]()
D.反应过程中的氧化反应所得产物均为![]()
【答案】B
【解析】
还原性![]() ,所以首先是发生以下反应离子方程式:
,所以首先是发生以下反应离子方程式:![]() ,继续加入
,继续加入![]() ,氧化性
,氧化性![]() ,所以
,所以![]() 可以结合H+氧化I-生成I2,离子方程式是
可以结合H+氧化I-生成I2,离子方程式是![]() 。
。
A.![]() 间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钾的物质的量是1mol,亚硫酸氢钠的物质的量是3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:
间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钾的物质的量是1mol,亚硫酸氢钠的物质的量是3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:![]() ,b点时的还原产物是
,b点时的还原产物是![]() ,故A错误;
,故A错误;
B.当![]() 时,0~b间离子方程式为:
时,0~b间离子方程式为:![]() ,b点时的还原产物是
,b点时的还原产物是![]() ,消耗碘酸钾1mol,生成碘离子是1mol,b~c段的离子方程式是
,消耗碘酸钾1mol,生成碘离子是1mol,b~c段的离子方程式是![]() ,当
,当![]() 时,消耗碘离子是0.5mol,溶液中
时,消耗碘离子是0.5mol,溶液中![]() ,故B正确;
,故B正确;
C.a点碘酸钾的物质的量是0.4mol,根据碘酸钾和亚硫酸氢钠的关系式知,消耗NaHSO3的物质的![]() ,剩余的是
,剩余的是![]() ,故C错误;
,故C错误;
D.反应过程中的氧化反应所得产物开始时是硫酸根,后期生成硫酸根和碘单质,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.C3H8中碳原子都采用的是sp3杂化
B.O2、CO2、N2都是非极性分子
C.酸性:H2CO3<H3PO4<H2SO4<HClO
D.CO的一种等电子体为NO+,它的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写反应的化学方程式或离子方程式:
(1)某地污水中的有机污染物主要成分是三氯乙烯![]() ,向此污水中加入
,向此污水中加入![]() 高锰酸钾被还原为
高锰酸钾被还原为![]() 溶液可将其中的三氯乙烯除去,氧化产物只有
溶液可将其中的三氯乙烯除去,氧化产物只有![]() ,写出该反应的化学方程式:_____________。
,写出该反应的化学方程式:_____________。
(2)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉![]() ,同时产生二氧化碳气体,该反应的离子方程式为_______。
,同时产生二氧化碳气体,该反应的离子方程式为_______。
(3)已知![]() 能与稀硫酸反应,生成一种淡黄色不溶物和一种气体
能与稀硫酸反应,生成一种淡黄色不溶物和一种气体![]() 标准状况下的密度为
标准状况下的密度为![]() ,写出该反应的离子方程式:______。
,写出该反应的离子方程式:______。
(4)一定条件下,向![]() 溶液中滴加碱性
溶液中滴加碱性![]() 溶液,溶液中
溶液,溶液中![]() 元素的化合价为
元素的化合价为![]() 与
与![]() 反应生成纳米铁粉、
反应生成纳米铁粉、![]() 和
和![]() ,其离子方程式为_____________。
,其离子方程式为_____________。
(5)![]() 与碘化钾在稀硫酸中反应的离子方程式为_____________。
与碘化钾在稀硫酸中反应的离子方程式为_____________。
(6)![]() 还原性较强,在溶液中易被
还原性较强,在溶液中易被![]() 氧化成
氧化成![]() ,常用作脱氯剂,该反应的离子方程式为_____________。
,常用作脱氯剂,该反应的离子方程式为_____________。
(7)![]() 可与KOH和
可与KOH和![]() 在高温下反应,生成产物之一为
在高温下反应,生成产物之一为![]() ,反应的化学方程式为_____________。
,反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaClO溶液吸收NO尾气,可提高尾气中NO的去除率。其他条件相同时,NO(转化为![]() )的转化率随NaClO溶液初始pH用稀硫酸调节
)的转化率随NaClO溶液初始pH用稀硫酸调节![]() 的变化如图所示。下列说法正确的是
的变化如图所示。下列说法正确的是
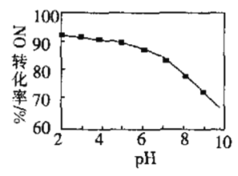
A.HClO氧气NO的能力比NaClO强
B.向NaClO溶液中通入NO后,溶液pH增大
C.若要吸收4.48LNO,则消耗3molNaClO
D.NaClO溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe3++SO32-+H2O![]() 2Fe2++SO42-+2H+,如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,A是灵敏电流表,其指针总是偏向电源负极,A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是( )
2Fe2++SO42-+2H+,如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,A是灵敏电流表,其指针总是偏向电源负极,A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是( )
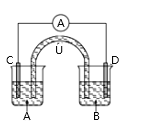
A.A指针向右偏转
B.U中阳离子向左烧杯移动
C.一段时间后,化学反应达到平衡状态,导线中无电流通过
D.一段时间后,右烧杯中溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,甲、乙两池中均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始时先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流表指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是( )

A. 闭合K1,断开K2后,A电极增重
B. 闭合K1,断开K2后,乙池溶液浓度上升
C. 断开K1,闭合K2后,A电极发生氧化反应
D. 断开K1,闭合K2后,NO![]() 向B电极移动
向B电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
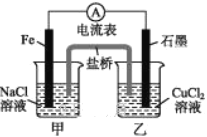
(1)如图所示为某实验小组设计的原电池装置,依据的氧化还原为(用离子反应方程式表示)_____________________________________。
反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过_____mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________,这是由于NH4Cl溶液显____(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因:_____________________,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式:_________________________________________。
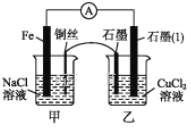
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞溶液,现象是________________,电极反应为_________________________;乙装置中石墨(1)为____(填“正”“负”“阴”或“阳”)极,乙装置中与铜丝相连石墨电极上发生的反应式为________________,产物常用___________________ 检验,反应的离子方程式为 _____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列操作会引起测定结果偏高的是
①滴定时,装待测溶液的锥形瓶有少量水
②酸式滴定管用蒸馏水洗后,未用标准溶液洗
③滴定终点读数时,仰视
④量取氢氧化钠溶液时,量取前有气泡,量取后气泡消失
A.③B.②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮(![]() )在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如下图所示。下列说法正确的是
)在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如下图所示。下列说法正确的是
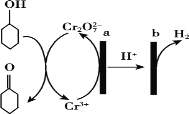
A.a极与电源负极相连
B.a极电极反应式是2Cr3++7H2O —6e-=Cr2O72-+14H+
C.b极发生氧化反应
D.理论上有1mol环己酮生成时,有2mol氢气放出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com