
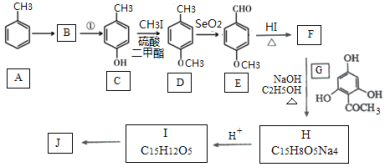
【题目】根皮素J(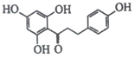 )是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
已知:
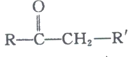 +R’’CHO
+R’’CHO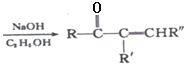 +H2O
+H2O
回答下列问题:
(1)C的化学名称是___________.E中的官能团的名称为_______________.
(2)B为溴代烃,请写出A→B的反应条件___________.
(3)写出由C生成D和由D生成E的反应类型___________、___________.
(4)F→H的化学方程式为______________________.
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①能与FeCl3溶液发生显色反应 ②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线_______(无机试剂任选).
的合成路线_______(无机试剂任选).
【答案】对甲基苯酚或4-甲基苯酚 醛基、醚键 铁、液溴 取代反应 氧化反应 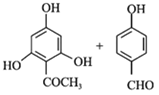 +4NaOH
+4NaOH![]()
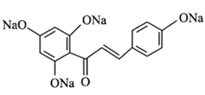 +5H2O 13
+5H2O 13 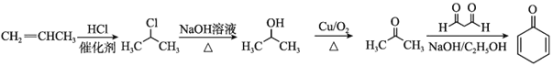
【解析】
通过对流程图分析,可以得出,B为![]() ,F为
,F为![]() ,H为
,H为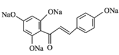 ,I为
,I为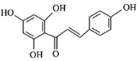 。
。
(1)C的化学名称是对甲基苯酚或4-甲基苯酚,E中的官能团的名称为醛基、醚键。
(2)B为![]() ,
,![]() →
→![]() 的反应条件为苯的同系物溴代反应的条件。
的反应条件为苯的同系物溴代反应的条件。
(3)由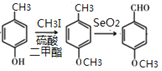 的反应类型为取代反应、氧化反应。
的反应类型为取代反应、氧化反应。
(4) ![]() →
→ 的反应方程式为
的反应方程式为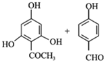 +4NaOH
+4NaOH![]()
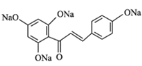 +5H2O。
+5H2O。
(5)M是![]() 的同分异构体,同时符合下列条件的M的结构为
的同分异构体,同时符合下列条件的M的结构为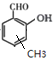 (共4种)、
(共4种)、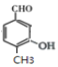 (移动-CH3,共4种)、
(移动-CH3,共4种)、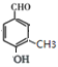 (移动-CH3,共2种)、
(移动-CH3,共2种)、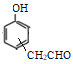 (共3种)。
(共3种)。
(6)根据已知信息,结合题给原料1,3-丙二醛和丙烯,若要制备![]() ,需要由丙烯制得丙酮,丙酮和1,3-丙二醛发生已知信息中的反应得到
,需要由丙烯制得丙酮,丙酮和1,3-丙二醛发生已知信息中的反应得到![]() 。
。
(1)C的化学名称是对甲基苯酚或4-甲基苯酚,E中的官能团的名称为醛基、醚键。答案为:对甲基苯酚或4-甲基苯酚;醛基、醚键;
(2)B为![]() ,
, ![]() →
→![]() 的反应条件为铁、液溴。答案为:铁、液溴;
的反应条件为铁、液溴。答案为:铁、液溴;
(3)由 的反应类型为取代反应、氧化反应。答案为:取代反应;氧化反应;
的反应类型为取代反应、氧化反应。答案为:取代反应;氧化反应;
(4) ![]() →
→ 的反应方程式为
的反应方程式为 +4NaOH
+4NaOH![]()
 +5H2O。答案为:
+5H2O。答案为: +4NaOH
+4NaOH![]()
 +5H2O;
+5H2O;
(5)M是![]() 的同分异构体,同时符合下列条件的M的结构为
的同分异构体,同时符合下列条件的M的结构为 (共4种)、
(共4种)、 (移动-CH3,共4种)、
(移动-CH3,共4种)、 (移动-CH3,共2种)、
(移动-CH3,共2种)、 (共3种),共计13种。答案为:13;
(共3种),共计13种。答案为:13;
(6)根据已知信息,结合题给原料1,3-丙二醛和丙烯,若要制备![]() ,需要由丙烯制得丙酮,丙酮和1,3-丙二醛发生已知信息中的反应得到
,需要由丙烯制得丙酮,丙酮和1,3-丙二醛发生已知信息中的反应得到![]() 。合成路线为
。合成路线为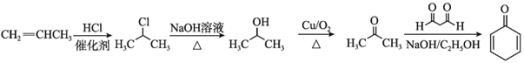
答案为: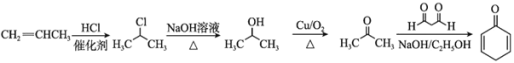 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】据报道,最近有科学家设计了一种在常压下运行的集成BaZrO3基质子陶瓷膜反应器( PCMR) ,将PCMR与质子陶瓷燃料电池相结合进行电化学法合成氨的原理如图所示,下列说法正确的是
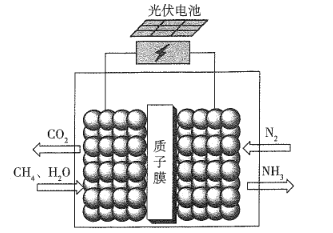
A.阳极的电极反应式为CH4+2H2O+8e-=CO2 +8H+
B.阴极可能发生副反应2H+ +2e- =H2 ↑
C.质子(H+)通过交换膜由阴极区向阳极区移动
D.理论上电路中通过3 mol电子时阴极最多产生22.4 L NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。
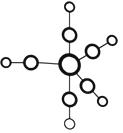
(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。
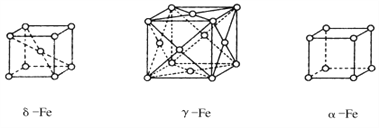
①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格氏试剂RMgX由Mg和卤代烃RX在干燥下的乙醚中反应制得,广泛用于复杂有机物的合。下图是著名香料(![]() )的合成路线。
)的合成路线。

(1)写出反应Ⅰ的反应条件____,反应Ⅱ的反应类型为____,化合物C的名称是____。
(2)写出下列物质的结构简式: E____ , F____。
(3)写出苯 → C的化学方程式:____
(4)A有多种同分异构体,其中苯环上有两种化学环境氢的同分异构体(含-MgBr结构)有____种。
(5)设计原料(![]() )合成产物(
)合成产物( )的合成路线:____
)的合成路线:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是35%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 增大C,B的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A (C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):
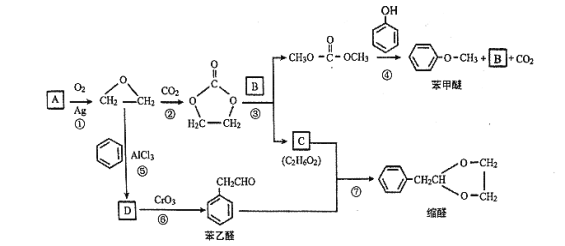
已知:![]()
回答下列问题:
(1)B的分子式是_______,C中含有的官能团名称是_______。
(2)若D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子, D中氧元素的质量分数约为13.1%,则D的结构简式为_______,⑥的反应类型是_______。
(3)据报道,反应⑦在微波辐射下,以NaHSO4·H2O为催化剂进行,请写出此反应的化学方程式:_______。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:_______。
i .含有苯环和结构![]()
ii.核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1
(5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色的E的所有同分异构体共有_______ (不考虑立体异构)种。
(6)参照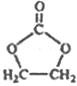 的合成路线,写出由2-氯丙烷和必要的无机试剂制备
的合成路线,写出由2-氯丙烷和必要的无机试剂制备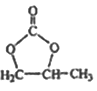 的合成流程图:_______。
的合成流程图:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减轻汽车尾气造成的大气污染,人们开始探索利用 NO 和 CO 在一定条件下 转化为 两种无毒气体E和F的方法(已知该反应△H<0). 在2L密闭容器中加入一定量 NO和CO,当温度分别在 T1 和 T2 时,测得各物质平衡时物质的量如下表:
n(mol) | NO | CO | E | F |
初始 | 0.100 | 0.100 | 0 | 0 |
T1 | 0.020 | 0.020 | 0.080 | 0.040 |
T2 | 0.010 | 0.010 | 0.090 | 0.045 |
(1)请结合上表数据,写出 NO 与 CO 反应的化学方程式_________________________________。
(2)根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2 B. T1<T2 C. T1=T2 D.无法比较
(3)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH=- 1266.8 kJ/mol,N2(g) + O2(g) = 2NO(g) ΔH = + 180.5kJ/mol,则氨催化氧化的热化学方程式为:________________________。
(4)500℃下,在 A、B 两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。
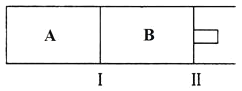
当合成氨在容器 B 中达平衡时,测得其中含有 1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为_______________;保持温度和体积不变,向此容器中通入0.36molN2,平衡将__________________(填“正向”、“逆向”或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和甲烷催化合成CO和H2是CO2资源化利用的有效途径。主要反应为
Ⅰ:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
(1)已知CH4(g)+H2O(g) ![]() CO(g)+H2(g) △H=+206kJ/mol
CO(g)+H2(g) △H=+206kJ/mol
写出CH4和水蒸气反应生成CO2的热化学方程式_________。
(2)在恒温、恒容的密闭容器中发生反应I,下列选项能够说明反应I达到平衡状态的是______。
A.混合气体的密度不变
B.混合气体的总压强不变
C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2
D.3V正(H2)=V逆(CH4)
E.混合气体的平均相对分子质量不变
(3)催化合成的温度通常维持在550-750℃之间,从反应速率角度分析其主要原因可能是_________。
(4)将CH4与CO2各1mol充入某密闭容器中,发生反应I。100Kpa时,反应I到达平衡时CO2的体积分数与温度的关系曲线如图所示。
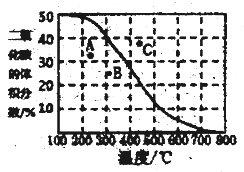
①图中A、B、C三点表示不同温度、压强下达到平衡时CO2的体积分数,则______点对应的平衡常数最小,判断依据是________;__________点对应的压强最大。
②300℃,100Kpa下,该容器中反应I经过40min达到平衡,计算反应在0-40min内的平均反应速率为v(CO2)=_________mol/min(结果保留两位有效数字),该温度下的压强平衡常数Kp=________。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2 FeO4在水中不稳定,发生反应:![]() +l0H2O
+l0H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 ( )
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 ( )
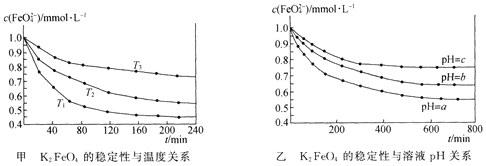
A.由图甲可知上述反应 △H < 0
B.由图甲可知温度:T1 > T2 > T3
C.由图甲可知K2 FeO4的稳定性随温度的升高而减弱
D.由图乙可知图中a < c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com