
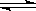 H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )| A.c(H+)随着温度升高而升高 | B.35℃时,c(H+)>c(OH-) |
C.水的电离度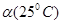 < <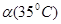 | D.水的电离是吸热的 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:不详 题型:单选题
| A.pH=3的硝酸跟pH=11的氢氧化钾溶液 |
| B.pH=3的盐酸跟pH=11的氨水 |
| C.0.1mol/LCH3COOH与0.1mol/LNaOH溶液 |
| D.pH=3的醋酸跟pH=11的氢氧化钡溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
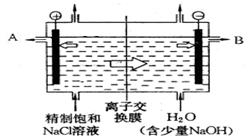
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(H+)很小的溶液一定呈碱性 | B.pH等于7的溶液一定呈中性 |
| C.c(H+)=c(OH-)的溶液一定呈中性 | D.不能使酚酞试液变红的溶液一定呈酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.A>B | B.A=10-6 B |
| C.B=10-6 A | D.A=B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com