
| A.pH=3的硝酸跟pH=11的氢氧化钾溶液 |
| B.pH=3的盐酸跟pH=11的氨水 |
| C.0.1mol/LCH3COOH与0.1mol/LNaOH溶液 |
| D.pH=3的醋酸跟pH=11的氢氧化钡溶液 |
科目:高中化学 来源:不详 题型:单选题
 H++OH—,在不同的温度下,其平衡常数K(25℃)=1×10-14, K(35℃)=2.1×10-14,则下列叙述正确的是:
H++OH—,在不同的温度下,其平衡常数K(25℃)=1×10-14, K(35℃)=2.1×10-14,则下列叙述正确的是:| A.c(H+)随着温度的升高而降低 | B.在35℃时,C(H+)> C(OH—) |
| C.在25℃时,水的电离常数为1.8×10-16 | D.水的电离是放热的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2H2(g) + O2(g) ==2H2O(l)ΔH==-572kJ·mol—1 |
| B.KOH(aq)+ CH3COOH (aq) =CH3COOK (aq)+H2O(l);△H=-57.3 kJ·mol–1 |
| C.C8H18(l)+ 12.5O2 (g) = 8CO2 (g)+ 9H2O(l);△H=-5518 kJ·mol–1 |
| D.CH4(g) + 2O2(g) ==CO2(g) + 2H2O(g)ΔH==-533kJ·mol—1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.混合液的pH=7 | B.混合液中c(B+)=c(A-) |
| C.a=b | D.加入甲基橙显橙色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,pH=3强酸HA溶液与pH=11NaOH溶液混合,c(Na+)= c(A-)>c(H+)= c(OH-) |
| B.c(NH4+)相等的①(NH4)2SO4溶液②NH4HSO4溶液③NH4Cl溶液,pH大小关系是③>①>② |
| C.标况下,2.24L H2S通入3mol/L100mL NaOH溶液,c(Na+) =2c(H2S)+ 2c(HS-)+2c(S2-) |
| D.0.1mol/L盐酸溶液与0.05mol/LNaAlO2溶液等体积混合,c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )| A.c(H+)随着温度升高而升高 | B.35℃时,c(H+)>c(OH-) |
C.水的电离度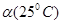 < <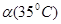 | D.水的电离是吸热的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com