
| A、硫酸 | B、氢氧化钾 |
| C、氯化铁 | D、硝酸钡 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、-285.8kJ/mol |
| B、285.8kJ/mol |
| C、-241.8kJ/mol |
| D、241.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c (HCN)<c (CN-) |
| B、c (Na+)>c (CN-) |
| C、c (HCN)-c (CN-)=c (OH-) |
| D、c (HCN)+c (CN-)=0.1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
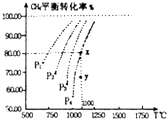 在一恒容的密闭窗口中充入0.1mol/LCO2,0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
在一恒容的密闭窗口中充入0.1mol/LCO2,0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )| A、上述反应的△H<0 |
| B、压强:P4>P3>P2>P1 |
| C、1100℃时该反应平衡常数为1.64 |
| D、压强为P4时,在y点:V正>V逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:
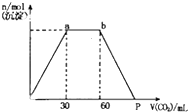 向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )
向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )| A、原混合物中n[Ba(OH)2]:n(KOH)=1:2 |
| B、p点坐标为120mL |
| C、p点溶液中溶质为Ba(HCO3)2 |
| D、a,b段反应分二阶段,离子方程式为:CO2+2OH-=CO32-+H2O CO32-+H2O+CO2=2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H>0表示放热反应,△H<0表示吸热反应 |
| B、热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C、1mol H2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D、1mol H2与0.5molO2反应放出的热就是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
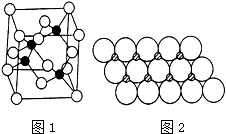 Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题:
Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com