
【题目】下图为结晶牛胰岛素分子结构示意图。已知胰岛素含有A、B两条多肽链,A链含有21个氨基酸,B链含有30个氨基酸,两条多肽链间通过两个二硫键(二硫键由两个—SH脱掉两个氢连接而成)连接,在A链上也形成1个二硫键。则胰岛素分子中含有的肽键数和51个氨基酸脱水缩合形成胰岛素后,相对分子质量比原来减少的数值各是( )
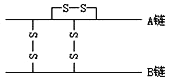
A. 49 882 B. 49 888 C. 50 882 D. 50 888
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )

A. Mg2+、Al3+、Ba2+ B. H+、Mg2+、Al3+
C. H+、Cu2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等.化学在解决雾霾污染中有着重要的作用.
(1)已知:2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol ﹣12NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
则反应NO2(g)+SO2(g)SO3(g)+NO(g)△H=kJmol﹣1 .
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K= .
(2)如图1是一种用NH3脱除烟气中NO的原理. 
①该脱硝原理中,NO最终转化为H2O和(填化学式).
②当消耗1mol NH3和0.5molO2时,除去的NO在标准状况下的体积为L.
(3)NO直接催化分解(生成N2和O2)也是一种脱硝途径.在不同条件下,NO的分解产物不同.在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示,写出NO分解的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题:
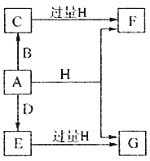
(1)A所含元素在周期表中的位置为______________,C的电子式为_______________。
(2)A与H在加热条件下反应的化学方程式为__________________。
(3)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为____________________。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为__________________。
(4)向含有0.4molF、0.1molG的混合溶液中加入过量盐酸,完全反应后收集到aL气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a=____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应 2AB+D 在四个不同条件下进行.B、D起始为0.反应物A的浓度(mol/L)随反应时间(min)变化情况如下表:
实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
1 | 800℃ | 1.0 | 0.8 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据表中数据完成下列填空:
(1)在实验1,反应在10至20min内的平均速率为mol/(L.min)
(2)在实验2,A的初始浓度C2=mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是 .
(3)设实验3的反应速率为υ3 , 实验1的反应速率为υ1 , 则υ3υ1(填“<“,“=“,“>“),且C31.0mol/L (填“<“,“>“或“=“).
(4)比较实验4和实验1,可推测该反应反应(填“吸热“或”放热“),理由是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧金属可以回收利用,用合金废料(含Fe、Cu和Al)制取FeSO4溶液和回收金属Cu。实验流程如图所示(部分生成物已略):

(1)合金属于________________(填“纯净物”或“混合物”)。
(2)生活中铝比铁更耐腐蚀的原因___________(用化学反应方程式解释)。
(3)步骤A化学反应方程式表示为:2Al+2NaOH+2R=== 2NaAlO2+3H2↑,依据质量守恒定律推出R的化学式为________。
(4)步骤B发生的化学反应方程式为___________;反应的基本类型为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL 0.01molL﹣1HA溶液中逐滴加入0.02molL﹣1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题: 
(1)由图中信息可知HA为酸(填“强”或“弱”),理由是
(2)常温下一定浓度的MA稀溶液的pH=a,则a7(填“>”、“<”或“=”),用离子方程式表示其原因为;,此时,溶液中由水电离出的c(OH﹣)= .
(3)请写出K点所对应的溶液中离子浓度的大小关系:
(4)K点对应的溶液中,c(M+)+c(MOH)2c(A﹣)(填“>”、“<”或“=”);若此时溶液中,pH=10,则c(MOH)+c(OH﹣)=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定铁铜合金的组成,将7.6g铁、铜合金加入100mL某浓度的稀硝酸中,待合金完全溶解后,共收集到NO气体2.24L(标准状况下),并测得溶液中H+的浓度为0.5molL﹣1 . 若反应前后溶液的体积变化忽略不计,则下列判断正确的是( )
A.上述反应中金属共失去电子0.1 mol
B.合金中,铜的质量为2.8 g
C.原硝酸的浓度:c(HNO3)=4.5 molL﹣1
D.要使溶液中的金属离子完全沉淀,需加5 molL﹣1的NaOH溶液60 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com