
【题目】常温下,向100mL 0.01molL﹣1HA溶液中逐滴加入0.02molL﹣1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题: 
(1)由图中信息可知HA为酸(填“强”或“弱”),理由是
(2)常温下一定浓度的MA稀溶液的pH=a,则a7(填“>”、“<”或“=”),用离子方程式表示其原因为;,此时,溶液中由水电离出的c(OH﹣)= .
(3)请写出K点所对应的溶液中离子浓度的大小关系:
(4)K点对应的溶液中,c(M+)+c(MOH)2c(A﹣)(填“>”、“<”或“=”);若此时溶液中,pH=10,则c(MOH)+c(OH﹣)=molL﹣1 .
【答案】
(1)强;0.01 mol?L﹣1HA的pH为2,说明HA完全电离
(2)<;M++H2O?MOH+H+;1×10﹣amol?L﹣1
(3)c(M+)>c(A﹣)>c(OH﹣)>c(H+)
(4)=;0.005
【解析】解:(1)根据图象知,0.01molL﹣1HA溶液中PH=2,氢离子浓度等于酸浓度,所以该酸是强酸, 所以答案是:强;0.01 molL﹣1HA的pH为2,说明HA完全电离; (2)N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,MA属于强酸弱碱盐,水解显示酸性,即a<7;原因是M+离子结合水电离的氢氧根离子生成了MOH,离子方程式为:M++H2OMOH+H+;水电离的氢氧根离子等于溶液中氢离子的浓度,即c(OH﹣)=1×10﹣amolL﹣1 ,
所以答案是:<;M++H2OMOH+H+;1×10﹣amolL﹣1;(3)由于在K点,MOH的物质的量远远大于HA的物质的量,溶液显示碱性,所以溶液中浓度大小关系为:c(M+)>c(A﹣)>c(OH﹣)>c(H+),
所以答案是:c(M+)>c(A﹣)>c(OH﹣)>c(H+); (4)K点时,加入的MOH的物质的量=0.02molL﹣1×0.1L=0.002mol,混合溶液的体积是0.2L,根据物料守恒知,c(M+)+c(MOH)= ![]() =0.01mol/L,
=0.01mol/L,
HA是强酸,所以反应后的溶液中,c(A﹣)= ![]() ×0.01molL﹣1=0.005molL﹣1 , 故c(M+)+c(MOH)=2c(A﹣);
×0.01molL﹣1=0.005molL﹣1 , 故c(M+)+c(MOH)=2c(A﹣);
根据电荷守恒可得:c(H+)+c(M+)=c(A﹣)+c(OH﹣),
由c(M+)+c(MOH)=0.01mol/L,可得c(M+)=0.01mol/L﹣c(MOH),带入电荷守恒公式可得:c(H+)+0.01mol/L﹣c(MOH)=c(A﹣)+c(OH﹣),
整理可得:c(MOH)+c(OH﹣)=c(H+)+0.01mol/L﹣c(A﹣)=10﹣10mol/L+0.01mol/L﹣0.005molL﹣1≈0.005molL﹣1 ,
所以答案是:=;0.005.
【考点精析】通过灵活运用酸碱中和滴定,掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点即可以解答此题.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2C2O4 | H2S |
电离平衡常数 | 1.8×10﹣5 | Ka1=5.4×10﹣2 | Ka1=1.3×10﹣7 |
请回答下列问题:
(1)H2S的一级电离常数表达式为Ka1=
(2)CH3COOH、H2C2O4、H2S的酸性由强到弱的顺序
(3)H2C2O4与少量的KOH溶液反应的化学方程式:
(4)NaHS溶液与NaHC2O4溶液反应的离子方程式:
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是(填写序号). ①反应所需要的时间B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A
⑤B中有锌剩余.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为结晶牛胰岛素分子结构示意图。已知胰岛素含有A、B两条多肽链,A链含有21个氨基酸,B链含有30个氨基酸,两条多肽链间通过两个二硫键(二硫键由两个—SH脱掉两个氢连接而成)连接,在A链上也形成1个二硫键。则胰岛素分子中含有的肽键数和51个氨基酸脱水缩合形成胰岛素后,相对分子质量比原来减少的数值各是( )
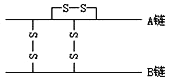
A. 49 882 B. 49 888 C. 50 882 D. 50 888
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的数据是( )
A.v(A)=0.9 mol/(Ls)
B.v(B)=0.5 mol/(Ls)
C.v(C)=1.4 mol/(Ls)
D.v(D)=1.8 mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像能正确反映对应变化关系的是( )
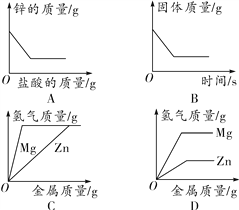
A. 向铜、锌混合物粉末中加入盐酸
B. 将铜片加入一定量的硝酸银溶液中
C. 向两份完全相同的稀盐酸中分别加入锌粉、镁粉
D. 向两份完全相同的稀盐酸中分别加入锌粉、镁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁及其化合物的说法中正确的是 ( )
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加铁粉,然后过滤
D.Fe3+与KSCN反应产生血红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方法错误的是( )
A.除去乙炔中混有的H2S气体通过盛有氢氧化钠溶液的洗气瓶
B.除去甲烷中混有的乙烯通过盛酸性高锰酸钾溶液的洗气瓶
C.除去酒精中的水加入足量生石灰后进行蒸馏
D.除去苯中混有的苯酚加入足量氢氧化钠溶液后进行分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3H2+N2 ![]() 2NH3在密闭容器中进行.下列关于该反应的说法错误的是( )
2NH3在密闭容器中进行.下列关于该反应的说法错误的是( )
A.升高温度能加快反应速率
B.使用恰当的催化剂能加快反应速率
C.增大N2的浓度能加快反应速率
D.平衡时各组分含量之比一定等于3:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g 时,隔板处于如图位置(保持温度不变),下列说法正确的是
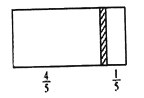
A. 右边CO与CO2分子数之比为1:3
B. 右侧CO的质量为14g
C. 右侧气体密度是相同条件下氧气密度的2倍
D. 若改变右边CO和CO2的充入量而使隔板处于距离右端1/3处,保持温度不变,则前后两次充入情况容器内的压强之比为5: 6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com