
【题目】小苏打长期放置在空气中会变质(部分转变为Na2CO3),某研究小组欲测定某小苏打样品中NaHCO3的质量分数,设计如下实验方案:
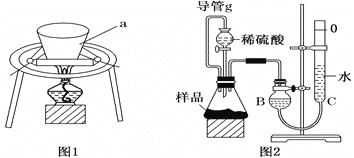
Ⅰ、加热分解法
利用图1装置,充分加热小苏打样品。
(1)仪器a的名称为___________________。
(2)在实验过程中,需要测量的实验数据有:
①仪器a的质量W1g;
②加热前,仪器a和样品的总质量W2g;
③加热冷却后,仪器a和残留物的总质量W3g。
(3)列出小苏打样品中NaHCO3的质量分数的计算式____________________
Ⅱ、测量气体体积法
利用图2装置,测定反应生成气体的体积。
(1)组装好仪器后,首先进行的操作为_________________________________________。
(2)导管g的作用为_________________________________________________________。
(3)为了减小实验误差,B、C中最好用________________溶液代替水。
(4)待反应结束,气体冷却至室温后,利用图示装置读取气体体积时,应注意的事项有:
①读数时应上下移动C管,使B、C两管液面相平;
②视线与液面最低处相平。
(5)若所取样品的质量为m g,反应前滴定管C的读数为V1 mL,反应结束后滴定管C的读数为V2 mL,则样品中NaHCO3和Na2CO3的物质的量之和为_______________(气体体积均已换算为标准状况下的体积)。
【答案】坩埚84(W2-W3)/31(W2-W1)检查装置气密性平衡分液漏斗与锥形瓶内的气压,使液体顺利流下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的气体体积误差饱和NaHCO3(V1-V2)/22400mol
【解析】
Ⅰ(1)根据仪器的形状和用途分析其名称。
(3)样品中碳酸氢钠固体受热发生分解,利用质量差量法进行计算出样品中纯碳酸氢钠固体的质量,然后计算样品中碳酸氢钠的质量分数。
Ⅱ(1)有气体生成的反应,实验过程中尽量避免气体的损失,要检查装置的气密性。
(2)g有平衡气压、使液体顺利流下,减少误差的作用。
(3)二氧化碳易溶于水,但难溶于饱和碳酸氢钠溶液。
(5)根据信息计算出反应产生二氧化碳气体的总量,然后根据C原子守恒计算NaHCO3和Na2CO3的物质的量之和。
Ⅰ(1)这是一个用来给固体加热的陶瓷仪器,该仪器名称是坩埚;正确答案:坩埚。
(3)设样品中含有纯碳酸氢钠为xg;根据题意分析可知:样品质量为(W2-W1)g,根据反应进行计算:
2NaHCO3 = Na2CO3+ CO2↑+ H2O 质量减少量
2×84 106 m=62
x (W2-W1)-((W3-W1)
列方程求出x=168(W2-W3)/62=84(W2-W3)/31 ;小苏打样品中NaHCO3的质量分数的计算式=[84(W2-W3)]/[31×(W2-W1)]=84(W2-W3)/31(W2-W1);正确答案:84(W2-W3)/31(W2-W1)。
Ⅱ(1)连接仪器后在实验前要检查装置气密性,否则可能导致实验失败;正确答案:检查装置气密性。
(2)①导管g的作用是:平衡分液漏斗与锥形瓶内的气压,使液体顺利流下,否则稀硫酸不易流下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的体积误差,而使测量更准确;正确答案:平衡分液漏斗与锥形瓶内的气压,使液体顺利流下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的气体体积误差。
(3)二氧化碳能溶于水,但难溶于饱和碳酸氢钠溶液,从而减少误差,所以可以用饱和碳酸氢钠代替水;正确答案:饱和NaHCO3。
(5)CO2气体体积=(V1-V2)mL,则n(CO2)=(V1-V2)×10-3/22.4mol;根据C原子守恒得:n(NaHCO3)+n(Na2CO3)=n(CO2)= (V1-V2)×10-3/22.4=(V1-V2)/22400mol;正确答案:(V1-V2)/22400mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某温度下HF的电离常数Ka=4×10-4 ,CaF2的溶度积常数Ksp=1.46×10-10。在该温度下取浓度为0.25 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是
A. 该温度下,0.25 mol·L-1的HF溶液的pH=2
B. 升高温度或增大浓度,HF的电离平衡常数都将增大
C. 两溶液混合不会产生沉淀
D. 向饱和的CaF2溶液中加入少量CaCl2固体后,溶度积常数Ksp一定比之前减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有下列键型的物质,可能为单质的是
A.只有离子键的物质B.既有离子键,又有非极性键的物质
C.既有极性键,又有离子键的物质D.只有非极性键的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝的碱式碳酸盐是中和胃酸药物的主要成分。欲测定某种镁和铝的碱式碳酸盐的成分进行了以下实验,根据以下实验记录,回答下列问题:
(1)称取6.02g该碱式碳酸盐,加入4.0mol/L盐酸使其溶解,当加入42.5mL时开始产生CO2,当加入盐酸至45.0mL时恰好完全溶解,该碱式碳酸盐中OH-与CO32- 的物质的量之比n(OH-)︰n(CO32-)=__________;
(2)在上述碱式碳酸盐恰好完全溶解所得溶液中加入过量的NaOH溶液,过滤,干燥(不分解)后得3.48g沉淀物。若该碱式碳酸盐中镁元素与氢元素的质量分数之比为6:1,试计算确定该碱式碳酸盐的化学式 __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,其工作原理是N2H4+O2=N2+2H2O,电池放电时,电子由b极经外电路流向a极。下列有关该燃料电池的说法正确的是( )
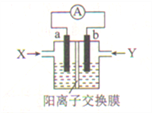
A. 该装置中,X为N2H4,Y为空气
B. 负极的电极反应式:O2+2H2O+4e-=4OH-
C. 电池工作时,b极附近溶液pH升高
D. 若电解质溶液为KOH溶液,则K+由右池通过交换膜向左池迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
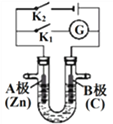
(1)断开K2,闭合K1,若所盛溶液为AgNO3溶液:则A为________极,B(石墨)极的电极反应式为________________。若所盛溶液为海水:则B极的电极反应式为______________________
(2)断开K1,闭合K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
A电极附近可观察到的现象是___________________________________,
检验B电极上产生的物质的方法_________________________________________,
该装置中发生的反应化学方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
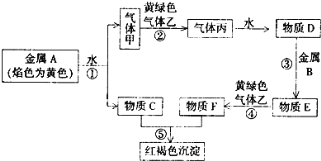
请回答下列问题:
(1)A的化学式为_____________,丙的化学式为_____________;
(2)写出下列反应的离子方程式:
①________________________
④_________________________
⑤________________________ 。
(3)写出C溶液与Al反应的离子方程式____________________。
(4)为鉴定B单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是_____________。
A. 碘水 B. NaOH溶液 C. KSCN溶液 D. Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某透明的酸性溶液中,能共存的的离子是( )
A.Na+、K+、SO42-、HCO3-B.Cu2+、K+、SO42-、NO3-
C.NH4+、CH3COO-、NO3-、Cl-D.Na+、K+、CO32-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com