
【题目】有机化合物的结构可用键线式表示,如CH2═CHCH2Br可表示为 ![]() .则关于有机物
.则关于有机物 ![]() 的说法正确的有( )
的说法正确的有( )
A.与苯互为同分异构体
B.其二氯代物有3种 (不考虑立体异构)
C.分子中所有的碳原子在同一平面上
D.属于烯烃,是乙烯的同系物
科目:高中化学 来源: 题型:
【题目】下列有关有机物A描述中正确的是( ) 
A.A分子中含有2个手性碳原子
B.A分子核磁共振氢谱有6种峰
C.0.1mol 有机物A能与足量的金属钠反应放出0.1mol氢气
D.A能发生的反应类型有:加成、取代、氧化、酯化、消去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙由如下反应制得:C4H10O ![]() C4H8
C4H8 ![]() C4H8Br2(丙),丙的结构简式不可能是( )
C4H8Br2(丙),丙的结构简式不可能是( )
A.CH3CH2CHBrCH2Br
B.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3
D.(CH3)2CBrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家屠呦呦因创制新型抗疟药﹣﹣青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( ) 
A.青蒿素的分子式为C15H22O5
B.青蒿素通过还原反应可制得双氢青蒿素
C.青蒿素有青蒿的芳香气味,是芳香族化合物
D.用有机溶剂乙醚从青蒿中提取青蒿素,主要采用萃取的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国北方大部分地区出现严重空气污染,其主要原因是化石燃料的大量使用。提高利用率,减少化石燃料燃烧所造成的环境污染,已成为人类面临的重大挑战。
(1)氢气是人类理想的能源。为了有效发展民用氢能源,首先必须制得廉价的氢气。下列可供开发且比较经济的制氢气的方法是________(填序号)。
①电解水 ②锌与稀硫酸反应 ③光解海水
制得氢气后还需要解决的问题是____(写出其中一个)。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
葡萄糖
b.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
c.CO2+CH4![]() CH3COOH
CH3COOH
d.2CO2+6H2![]() CH2===CH2+4H2O
CH2===CH2+4H2O
以上反应中,最节能的是________,原子利用率最高的是________。
(3)煤液化后可得到甲醇,甲醇在一定条件下与CO、H2作用生成有机物A,A发生加聚反应可生成高分子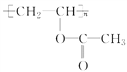 ,写出A的结构简式_________________。
,写出A的结构简式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+ ![]() O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为。
(2)也可将CH4设计成燃料电池,来解决能源问题,如下图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。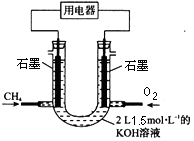
①0<V≤33.6L时,负极电极反应为。
②V=44.8L时,溶液中离子浓度大小关系为。
(3)工业合成氨时,合成塔中每产生1molNH3 , 放出46.1kJ的热量。
某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系 | ||
N2 | H2 | NH3 | |||
① | 1 | 4 | 0 | t1 min | 放出热量:36.88kJ |
② | 2 | 8 | 0 | t2 min | 放出热量:Q |
①容器①中,0-t1时间的平均反应速率为υ(H2)=。
②下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>73.76kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:①<②
e.两容器达到平衡时所用时间t1>t2
(4)下图是在反应器中将N2和H2按物质的量之比为1:3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。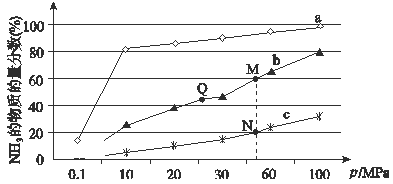
①曲线a对应的温度是。
②上图中M、N、Q点平衡常数K的大小关系是 。
③M点对应的H2转化率是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将BaSO4放入水中不能导电,所以硫酸钡不是电解质
B.NaCl溶液能导电,所以NaCl溶液是电解质
C.氯化氢溶于水能导电,所以盐酸是电解质
D.固态的NaCl不导电,熔融态NaCl可以导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3(s)+3H2(g) ![]() W (s) +3H2O (g) 请回答下列问题:
W (s) +3H2O (g) 请回答下列问题:
(1)上述反应的化学平衡常数表达式为。
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为;随着温度的升高,H2与水蒸气的体积比减小,则该反应为反应(填“吸热”或“放热”)。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
温度 | 25 ℃~550 ℃~600 ℃~700 ℃ |
主要成分 | WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为 ;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 。
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g) ![]() W(s)+2H2O (g) H=+66.0 kJmol1
W(s)+2H2O (g) H=+66.0 kJmol1
WO2(g)+2H2(g) ![]() W(s)+2H2O (g) H=-137.9 kJmol1
W(s)+2H2O (g) H=-137.9 kJmol1
则WO2(s) ![]() WO2(g)的 H=。
WO2(g)的 H=。
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+ 2 I2 (g) ![]() WI4 (g)。下列说法正确的有。
WI4 (g)。下列说法正确的有。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com