
【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+ ![]() O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为。
(2)也可将CH4设计成燃料电池,来解决能源问题,如下图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。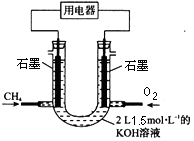
①0<V≤33.6L时,负极电极反应为。
②V=44.8L时,溶液中离子浓度大小关系为。
(3)工业合成氨时,合成塔中每产生1molNH3 , 放出46.1kJ的热量。
某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系 | ||
N2 | H2 | NH3 | |||
① | 1 | 4 | 0 | t1 min | 放出热量:36.88kJ |
② | 2 | 8 | 0 | t2 min | 放出热量:Q |
①容器①中,0-t1时间的平均反应速率为υ(H2)=。
②下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>73.76kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:①<②
e.两容器达到平衡时所用时间t1>t2
(4)下图是在反应器中将N2和H2按物质的量之比为1:3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。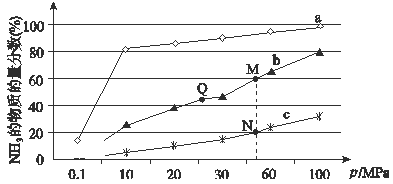
①曲线a对应的温度是。
②上图中M、N、Q点平衡常数K的大小关系是 。
③M点对应的H2转化率是。
【答案】
(1)CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=247.4KJ/mol
(2)CH4-8e-+10OH-=CO32-+7H2O;c(K+)> c(HCO3-)> c(CO32-)> c(OH-)> c(H+)
(3)![]() mol/(L·min);bde
mol/(L·min);bde
(4)200℃;Q=M>N;75%;
【解析】(1)根据盖斯定律可知,①×2-③可得CH4(g)+CO2(g)=2CO(g)+2H2(g),
所以其△H=[(+206.2)×2-(+165.0)]kJmol-1=+247.4 kJmol-1 , 所以CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4 kJmol-1;
(2)n(KOH)=1.5mol/L×2L=3mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;①当0<V≤33.6 L时,0<n(CH4)≤1.5mol,则0<n(CO2)≤1.5mol,发生反应①②,生成碳酸钾,则负极反应式为CH4-8e-+10OH-=CO32-+7H2O,故答案为:CH4-8e-+10OH-=CO32-+7H2O;②当V=44.8L时,n(CH4)=2mol,n(CO2)=2mol,则电池总反应式为2CH4+4O2+3KOH=K2CO3+KHCO3+5H2O,则得到1molK2CO3和1molKHCO3的溶液,则c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)①容器①中达到平衡时,生成的氨气的物质的量为 ![]() =0.8mol,因此反应的化学反应速率为v(H2)=
=0.8mol,因此反应的化学反应速率为v(H2)= ![]() =
= ![]() =
= ![]() mol/(L·min);
mol/(L·min);
②a、容器②中压强大于容器①,增大压强,平衡向正反应方向移动,平衡时,两容器中H2的体积分数不等,故a错误;
b、容器②中压强大于容器①,增大压强,平衡向正反应方向移动,放出的热量更多,大于容器①中放出热量的2倍,故b正确;
c、反应起始浓度不同,反应速率不同,故c错误;
d、恒温恒容容器中实验②起始量相当于实验①的2倍,相当于增大压强,增大压强,平衡向正反应方向移动,转化率增大,故d正确;
e、容器②中压强大于容器①,压强越大,反应速率越快,达到平衡时所用时间越少,故两容器达到平衡时所用时间t1>t2 , 故e正确;故选bde;
(4)①合成氨反应放热,温度越低氨气的百分含量越高,所以,曲线a对应的温度是200℃,故答案为:200℃;
②K只受温度影响,该反应温度升高时K值减小,b是400℃,c是600℃,上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故答案为:Q=M>N;
③
3N2(g)+ | 3H2(g) | 2NH3(g) | |
起始(mol) | 1 | 3 | 0 |
转化(mol) | x | 3x | 2x |
平衡(mol) | x | 3-3x | 2x |
据题意M点时: ![]() =60%,x=
=60%,x= ![]() ,
,
则氢气的转化率为: ![]() ×100%=75%
×100%=75%
故答案为:(1)CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4 kJmol-1;(2)CH4-8e-+10OH-=CO32-+7H2O;c(K+)> c(HCO3-)> c(CO32-)> c(OH-)> c(H+);(3)![]() ;bde;(4)75%;
;bde;(4)75%;
(1)根据盖斯定律书写热化学方程式;
(2)①当0<V≤33.6 L时,反应生成K2CO3;据此写出负极电极反应式;
②当V=44.8L时,反应生成等量的K2CO3、KHCO3 , 结合水解程度的大小比较,确定溶液中离子浓度;
(3)①根据反应速率的计算公式计算;
②结合平衡移动、反应速率的影响因素进行选项分析;
(4)①该反应为放热反应,温度越高,氨气的含量越小;
②平衡常数只受温度的影响,吸热反应,温度升高,平衡常数增大;
③结合三段式进行计算;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组在实验室中模拟石油的催化裂化,装置如图:实验过程中可观察到烧瓶Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味。
(1)该装置仪器连接的顺序应遵循的原则为_________________,加入药品之前的操作为____________________________,长导管的作用是_____________________________。
(2)试管Ⅱ中少量液体凝结说明了_______________________。
(3)试管Ⅲ中溶液褪色说明了____________________________。
(4)能否用试管Ⅱ中的液体萃取溴水中的溴,理由是__________________________。
(5)写出二十烷裂化得到癸烷和癸烯的化学方程式____________________________。
(6)石油裂化的重要意义是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( ) A
是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( ) A ![]() B
B ![]() C
C ![]()
![]()
A.B中含有的官能团有溴原子、碳碳双键
B.A的结构简式是CH2═CHCH2CH3
C.该有机烯醚不能发生加聚反应
D.①②③的反应类型分别为加成反应、取代反应、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物的结构可用键线式表示,如CH2═CHCH2Br可表示为 ![]() .则关于有机物
.则关于有机物 ![]() 的说法正确的有( )
的说法正确的有( )
A.与苯互为同分异构体
B.其二氯代物有3种 (不考虑立体异构)
C.分子中所有的碳原子在同一平面上
D.属于烯烃,是乙烯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g) ![]() 2SO3(g)△H<0的影响如图所示,下列说法正确的是( )
2SO3(g)△H<0的影响如图所示,下列说法正确的是( )
A.反应b、c点均为平衡点,a点未达平衡且向正反应方向进行
B.a、b、c三点的平衡常数Kb>Kc>Ka
C.上述图像可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高
D.a、b、c三点中,a点时SO2的转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图: 
![]()
![]() +H2O,
+H2O, 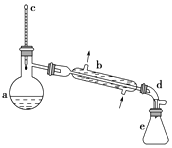
可能用到的有关数据如表:
相对分子质量 | 密度/(gcm﹣3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓H2SO4 , b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯12g.
回答下列问题:
(1)装置b的名称是 .
(2)本实验中最容易产生的副产物的结构简式为 , 生成该物质的反应类型是
(3)分液漏斗在使用前须清洗干净并 , 在本实验分离过程中,产物应该从分液漏斗的(填“上口倒出”或“下口倒出”).
(4)在环己烯粗产物蒸馏过程中,不可能用到的仪器有(填正确答案标号).
A.蒸馏烧瓶
B.温度计
C.分液漏斗
D.锥形瓶
E.蒸发皿
(5)本实验所得到的环己烯产率是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以黄铜矿(主要成分为CuFeS2)为原料制取胆矾晶体的流程:
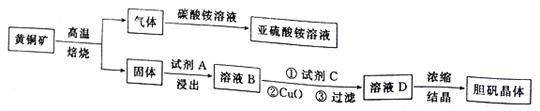
已知:
ⅰ.高温焙烧时的主要反应有:2CuFeS2+O2![]() Cu2S+2FeS+SO2
Cu2S+2FeS+SO2
2Cu2S+ 5O2![]() 2CuO+2CuSO4,2FeS+3O2
2CuO+2CuSO4,2FeS+3O2![]() 2FeO+2SO2 ;
2FeO+2SO2 ;
ⅱ.常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Cu(OH)2]=3.0×10-20。
(1)CuFeS2中硫元素的化合价为______________________,写出上述流程中生成亚硫酸铵的化学方程式:______________________________________________________________________。
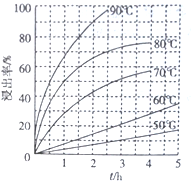
(2)最适合的试剂A是__________(写化学式)溶液;当试剂A的浓度为6.0mol·L-1时 ,“浸出”实验中,铜的浸出率结果如下图所示。由图可知,当铜的浸出率为90% 时,所采用的实验条件(温度、时间)为__________。
(3)最适合的试剂C是__________(填标号)。
a.Cl2b. H2O2 溶液 c.酸性高锰酸钾溶液 d.浓硫酸
(4)加入适量CuO粉末的作用是调节溶液的pH,促进Fe3+水解,达到除杂的目的。写出实现该目的的总反应的离子方程式:_________________________________________________________。
(5)有同学怀疑CuO不一定能达到上述目的,而小张同学却认为可以通过计算来确定。设溶液中Cu2+的浓度为3.0 mol·L-1,则Cu2+开始沉淀时溶液的pH 为__________,Fe3+沉淀完全时溶液的pH 为__________。通过计算判断加入CuO__________(填“能”或“不能”)达到目的(提示:1g 5=0.7;通常认为残留在溶液中的某离子浓度小于1.0×10-5 mol·L-1 时,就认为该离子已沉淀完全)。
(6)假设流程图中消耗的CuO为ag,最终制得bg胆矾晶体,消耗黄铜矿的质量为cg,不考虑生产过程中的损失,则黄铜矿中CuFeS2的质量分数为__________(写出原始的计算结果即可,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用具有相对应关系的是
A.苯酚显弱酸性,可用于杀菌消毒
B.氢氧化铝受热易分解,可用于中和胃酸
C.KOH溶液呈碱性,可用于油脂的皂化
D.C2H4能使酸性高锰酸钾褪色,可用于果实的催熟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定烟雾中的SO2含量,可做下列实验:取100 L该烟雾(标准状况),通过盛放100 mL过氧化氢(H2O2)水溶液的吸收瓶,使它们充分反应,生成硫酸。在吸收后的水溶液中加入BaCl2溶液,生成白色沉淀,经测定其质量为11.65 g,则该烟雾中SO2的体积分数是( )
A. 1.12% B. 2.24%
C. 3.36% D. 无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com