
【题目】![]() 是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( ) A
是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( ) A ![]() B
B ![]() C
C ![]()
![]()
A.B中含有的官能团有溴原子、碳碳双键
B.A的结构简式是CH2═CHCH2CH3
C.该有机烯醚不能发生加聚反应
D.①②③的反应类型分别为加成反应、取代反应、消去反应
科目:高中化学 来源: 题型:
【题目】可逆反应在一定条件下达到化学平衡时,下列说法不正确的是( )
A.正反应速率等于逆反应速率
B.各组分浓度不再发生变化
C.反应体系中某组分的组成保持不变
D.正、逆反应速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣24.8kJmol﹣1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=﹣47.2kJmol﹣1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJmol﹣1
则14g CO气体与足量FeO充分反应得到Fe单质和CO2气体时的释放或吸收的热量为( )
A.放出218 KJ
B.放出109kJ
C.吸收218 kJ
D.吸收109 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙由如下反应制得:C4H10O ![]() C4H8
C4H8 ![]() C4H8Br2(丙),丙的结构简式不可能是( )
C4H8Br2(丙),丙的结构简式不可能是( )
A.CH3CH2CHBrCH2Br
B.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3
D.(CH3)2CBrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关天然产物水解的叙述不正确的是( )
A.纤维素水解与淀粉水解得到的最终产物不同
B.蛋白质水解的最终产物均为氨基酸
C.可用碘检验淀粉水解是否完全
D.油脂水解可得到丙三醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家屠呦呦因创制新型抗疟药﹣﹣青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( ) 
A.青蒿素的分子式为C15H22O5
B.青蒿素通过还原反应可制得双氢青蒿素
C.青蒿素有青蒿的芳香气味,是芳香族化合物
D.用有机溶剂乙醚从青蒿中提取青蒿素,主要采用萃取的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国北方大部分地区出现严重空气污染,其主要原因是化石燃料的大量使用。提高利用率,减少化石燃料燃烧所造成的环境污染,已成为人类面临的重大挑战。
(1)氢气是人类理想的能源。为了有效发展民用氢能源,首先必须制得廉价的氢气。下列可供开发且比较经济的制氢气的方法是________(填序号)。
①电解水 ②锌与稀硫酸反应 ③光解海水
制得氢气后还需要解决的问题是____(写出其中一个)。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
葡萄糖
b.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
c.CO2+CH4![]() CH3COOH
CH3COOH
d.2CO2+6H2![]() CH2===CH2+4H2O
CH2===CH2+4H2O
以上反应中,最节能的是________,原子利用率最高的是________。
(3)煤液化后可得到甲醇,甲醇在一定条件下与CO、H2作用生成有机物A,A发生加聚反应可生成高分子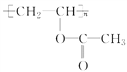 ,写出A的结构简式_________________。
,写出A的结构简式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+ ![]() O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为。
(2)也可将CH4设计成燃料电池,来解决能源问题,如下图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。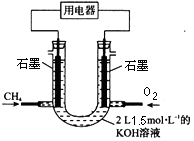
①0<V≤33.6L时,负极电极反应为。
②V=44.8L时,溶液中离子浓度大小关系为。
(3)工业合成氨时,合成塔中每产生1molNH3 , 放出46.1kJ的热量。
某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系 | ||
N2 | H2 | NH3 | |||
① | 1 | 4 | 0 | t1 min | 放出热量:36.88kJ |
② | 2 | 8 | 0 | t2 min | 放出热量:Q |
①容器①中,0-t1时间的平均反应速率为υ(H2)=。
②下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>73.76kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:①<②
e.两容器达到平衡时所用时间t1>t2
(4)下图是在反应器中将N2和H2按物质的量之比为1:3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。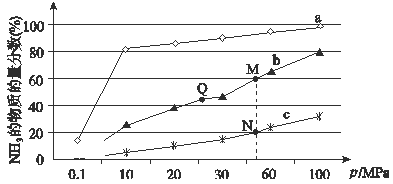
①曲线a对应的温度是。
②上图中M、N、Q点平衡常数K的大小关系是 。
③M点对应的H2转化率是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4 , 其流程如下: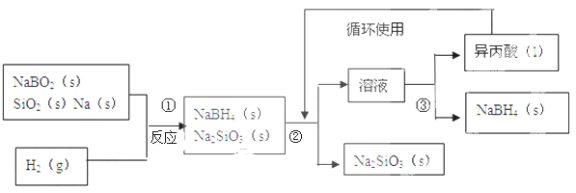
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:33℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是 ,原料中的金属钠通常保存在 中,实验室取用少量金属钠需要用到的实验用品有 , ,玻璃片和小刀等;
(2)请配平第①步反应的化学方程式: NaBO2+ SiO2+ Na+ H2=NaBH4+2Na2SiO3;
(3)第②步分离采用的方法是 ;第③步分离(NaBH4)并回收溶剂,采用的方法是 .
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25℃,101KPa下,已知每消耗3.8克NaBH4(s)放热21.6KJ,该反应的热化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com