
【题目】已知下列热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣24.8kJmol﹣1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=﹣47.2kJmol﹣1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJmol﹣1
则14g CO气体与足量FeO充分反应得到Fe单质和CO2气体时的释放或吸收的热量为( )
A.放出218 KJ
B.放出109kJ
C.吸收218 kJ
D.吸收109 kJ
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】常温下,将0.40mol/L氢氧化钠溶液与0.10mol/L硫酸溶液等体积混合,该混合溶液的pH为( )
A.1.0
B.2.0
C.13.0
D.14.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在实验室中模拟石油的催化裂化,装置如图:实验过程中可观察到烧瓶Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味。
(1)该装置仪器连接的顺序应遵循的原则为_________________,加入药品之前的操作为____________________________,长导管的作用是_____________________________。
(2)试管Ⅱ中少量液体凝结说明了_______________________。
(3)试管Ⅲ中溶液褪色说明了____________________________。
(4)能否用试管Ⅱ中的液体萃取溴水中的溴,理由是__________________________。
(5)写出二十烷裂化得到癸烷和癸烯的化学方程式____________________________。
(6)石油裂化的重要意义是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )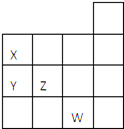
①X、Y的最高价氧化物的水化物酸性为Y<X
②Y、Z的气态氢化物的稳定性Y<Z
③W的单质常温下呈液态,一定条件下可与铁粉反应
④W的原子序数比Z大9
A.只有③
B.①②
C.①②③
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是( )
A.氯化铁溶液 饱和溴水
B.碳酸钠溶液 饱和溴水
C.酸性高锰酸钾溶液 饱和溴水
D.酸性高锰酸钾溶液 氯化铁溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】12 g某有机物X完全燃烧后生成17.6 g CO2和7.2 g H2O。
(1)如果X是有刺激性气味的无色液体,跟金属钠、碳酸钠均能反应并放出气体,则它的结构简式为________。
(2)如果X是易挥发有果香味的无色液体,并能水解,则它的结构简式为______________。
(3)如果X的相对分子质量为90,跟醇、羧酸都能发生酯化反应,且两分子的X之间互相反应生成如下环酯: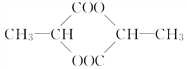 ,则X的结构简式为__________________。
,则X的结构简式为__________________。
(4)如果X的分子中有6个碳原子,能发生银镜反应,则它的结构简式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( ) A
是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( ) A ![]() B
B ![]() C
C ![]()
![]()
A.B中含有的官能团有溴原子、碳碳双键
B.A的结构简式是CH2═CHCH2CH3
C.该有机烯醚不能发生加聚反应
D.①②③的反应类型分别为加成反应、取代反应、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以黄铜矿(主要成分为CuFeS2)为原料制取胆矾晶体的流程:
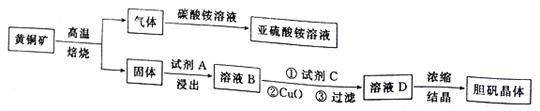
已知:
ⅰ.高温焙烧时的主要反应有:2CuFeS2+O2![]() Cu2S+2FeS+SO2
Cu2S+2FeS+SO2
2Cu2S+ 5O2![]() 2CuO+2CuSO4,2FeS+3O2
2CuO+2CuSO4,2FeS+3O2![]() 2FeO+2SO2 ;
2FeO+2SO2 ;
ⅱ.常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Cu(OH)2]=3.0×10-20。
(1)CuFeS2中硫元素的化合价为______________________,写出上述流程中生成亚硫酸铵的化学方程式:______________________________________________________________________。
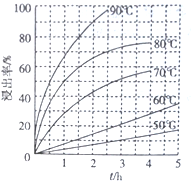
(2)最适合的试剂A是__________(写化学式)溶液;当试剂A的浓度为6.0mol·L-1时 ,“浸出”实验中,铜的浸出率结果如下图所示。由图可知,当铜的浸出率为90% 时,所采用的实验条件(温度、时间)为__________。
(3)最适合的试剂C是__________(填标号)。
a.Cl2b. H2O2 溶液 c.酸性高锰酸钾溶液 d.浓硫酸
(4)加入适量CuO粉末的作用是调节溶液的pH,促进Fe3+水解,达到除杂的目的。写出实现该目的的总反应的离子方程式:_________________________________________________________。
(5)有同学怀疑CuO不一定能达到上述目的,而小张同学却认为可以通过计算来确定。设溶液中Cu2+的浓度为3.0 mol·L-1,则Cu2+开始沉淀时溶液的pH 为__________,Fe3+沉淀完全时溶液的pH 为__________。通过计算判断加入CuO__________(填“能”或“不能”)达到目的(提示:1g 5=0.7;通常认为残留在溶液中的某离子浓度小于1.0×10-5 mol·L-1 时,就认为该离子已沉淀完全)。
(6)假设流程图中消耗的CuO为ag,最终制得bg胆矾晶体,消耗黄铜矿的质量为cg,不考虑生产过程中的损失,则黄铜矿中CuFeS2的质量分数为__________(写出原始的计算结果即可,不必化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com