
【题目】硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4 , 其流程如下: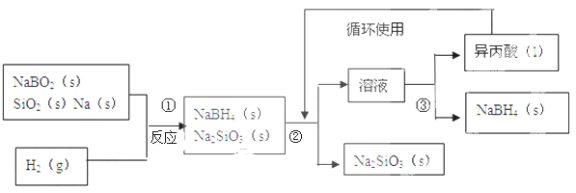
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:33℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是 ,原料中的金属钠通常保存在 中,实验室取用少量金属钠需要用到的实验用品有 , ,玻璃片和小刀等;
(2)请配平第①步反应的化学方程式: NaBO2+ SiO2+ Na+ H2=NaBH4+2Na2SiO3;
(3)第②步分离采用的方法是 ;第③步分离(NaBH4)并回收溶剂,采用的方法是 .
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25℃,101KPa下,已知每消耗3.8克NaBH4(s)放热21.6KJ,该反应的热化学方程式是 。
【答案】
(1)除去反应器中的水蒸气和空气;煤油;镊子;滤纸
(2)1;2;4;2
(3)过滤;蒸馏
(4)NaBH4 ( s)+2 H2O(1)=NaBO2 ( s) +4H2(g) △H=-216. 0KJ/mol
【解析】(1)由于NaBH4常温下能与水反应,且Na比较活泼,加执到100度以上,充入氩气,是除去反应器中的水蒸气和空气,避免影响反应:少量金属钠保存在煤油里:取用钠时,用镊子夹取,滤纸吸干表面的煤油;(2)根据氧化还原反应原理,得失电子总相同,可以配平此反应为:![]() +2
+2![]() +4Na+2
+4Na+2![]() =
=![]() +
+![]() ;( 3 )从流程图中可以看出第②步分离的是适体和液体混合物,所以选用过滤的方法:第③步分离(
;( 3 )从流程图中可以看出第②步分离的是适体和液体混合物,所以选用过滤的方法:第③步分离(![]() )并回收溶剂,只能先将溶剂蒸发再冷凝回收,即蒸馏的方法分离;(4)根据物质的量计算,n(
)并回收溶剂,只能先将溶剂蒸发再冷凝回收,即蒸馏的方法分离;(4)根据物质的量计算,n(![]() )=0.1mol,.故热方程式为: NaBH4 ( s) +2 H2O(1)=NaBO2 ( s) +4H2(g) △H=-216. 0KJ/mol;
)=0.1mol,.故热方程式为: NaBH4 ( s) +2 H2O(1)=NaBO2 ( s) +4H2(g) △H=-216. 0KJ/mol;
【考点精析】通过灵活运用化学实验操作的先后顺序,掌握化学实验顺序遵循:“从下往上”原则;“从左到右”原则;先“塞”后“定”原则;“固体先放”原则;“液体后加”原则;先验气密性(装入药品前进行)原则;后点酒精灯(所有装置完毕后再点酒精灯)原则即可以解答此题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】![]() 是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( ) A
是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( ) A ![]() B
B ![]() C
C ![]()
![]()
A.B中含有的官能团有溴原子、碳碳双键
B.A的结构简式是CH2═CHCH2CH3
C.该有机烯醚不能发生加聚反应
D.①②③的反应类型分别为加成反应、取代反应、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以黄铜矿(主要成分为CuFeS2)为原料制取胆矾晶体的流程:
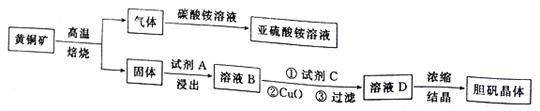
已知:
ⅰ.高温焙烧时的主要反应有:2CuFeS2+O2![]() Cu2S+2FeS+SO2
Cu2S+2FeS+SO2
2Cu2S+ 5O2![]() 2CuO+2CuSO4,2FeS+3O2
2CuO+2CuSO4,2FeS+3O2![]() 2FeO+2SO2 ;
2FeO+2SO2 ;
ⅱ.常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Cu(OH)2]=3.0×10-20。
(1)CuFeS2中硫元素的化合价为______________________,写出上述流程中生成亚硫酸铵的化学方程式:______________________________________________________________________。
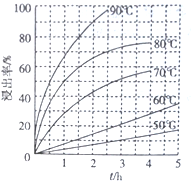
(2)最适合的试剂A是__________(写化学式)溶液;当试剂A的浓度为6.0mol·L-1时 ,“浸出”实验中,铜的浸出率结果如下图所示。由图可知,当铜的浸出率为90% 时,所采用的实验条件(温度、时间)为__________。
(3)最适合的试剂C是__________(填标号)。
a.Cl2b. H2O2 溶液 c.酸性高锰酸钾溶液 d.浓硫酸
(4)加入适量CuO粉末的作用是调节溶液的pH,促进Fe3+水解,达到除杂的目的。写出实现该目的的总反应的离子方程式:_________________________________________________________。
(5)有同学怀疑CuO不一定能达到上述目的,而小张同学却认为可以通过计算来确定。设溶液中Cu2+的浓度为3.0 mol·L-1,则Cu2+开始沉淀时溶液的pH 为__________,Fe3+沉淀完全时溶液的pH 为__________。通过计算判断加入CuO__________(填“能”或“不能”)达到目的(提示:1g 5=0.7;通常认为残留在溶液中的某离子浓度小于1.0×10-5 mol·L-1 时,就认为该离子已沉淀完全)。
(6)假设流程图中消耗的CuO为ag,最终制得bg胆矾晶体,消耗黄铜矿的质量为cg,不考虑生产过程中的损失,则黄铜矿中CuFeS2的质量分数为__________(写出原始的计算结果即可,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用具有相对应关系的是
A.苯酚显弱酸性,可用于杀菌消毒
B.氢氧化铝受热易分解,可用于中和胃酸
C.KOH溶液呈碱性,可用于油脂的皂化
D.C2H4能使酸性高锰酸钾褪色,可用于果实的催熟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分元素在元素周期表中位置,根据下列要求回答问题:
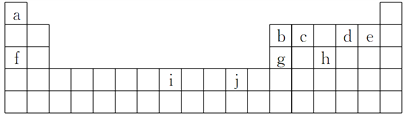
(1)下列关于Ca、97Bk(锫)、![]() Uus和
Uus和![]() Uus的说法中不正确的是____(填字母,下同)。
Uus的说法中不正确的是____(填字母,下同)。
A.117号元素的相对原子质量为293.5
B.![]() Uus和
Uus和![]() Uus互为同位素
Uus互为同位素
C. Ca、97Bk表示两种原子、两种元素
D.上述元素都位于长周期中
(2)根据元素周期表结构推知,117号元素在周期表中的位置是________。
A.第七周期第ⅣA族
B.第七周期第ⅦA族
C.第六周期第ⅣA族
D.第六周期第ⅦA族
(3)117号元素Uus属于________(填“金属元素”或“非金属元素”),它的气态氢化物稳定性比砹的气态氢化物稳定性________(填“强”或“弱”);它的最高价氧化物的化学式为________________。
(4)下列关于上述元素及其化合物的判断正确的是________(填字母)。
A.53I、55Cs和55Cs放射性元素变成其他元素,发生了化学变化
B.he3分子和ha3分子结构相同
C.j元素与d元素组成化合物的颜色相同
D.加碘食盐中“碘”不是碘53I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定烟雾中的SO2含量,可做下列实验:取100 L该烟雾(标准状况),通过盛放100 mL过氧化氢(H2O2)水溶液的吸收瓶,使它们充分反应,生成硫酸。在吸收后的水溶液中加入BaCl2溶液,生成白色沉淀,经测定其质量为11.65 g,则该烟雾中SO2的体积分数是( )
A. 1.12% B. 2.24%
C. 3.36% D. 无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com