
【题目】下列说法中,错误的是
A.蔗糖、淀粉、纤维素水解的最终产物都只是葡萄糖
B.误服重金属盐,立即服用牛奶或豆浆可解毒
C.油脂、乙酸乙酯都属于酯类,但不是同系物
D.煤的干馏可以得到苯、甲苯等芳香烃
 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )(可能用到的相对原子质量:O—16 Na—23)
A. 含1 mol FeCl3的饱和溶液最多可形成胶体粒子数为NA
B. 1 mol Fe溶于过量硝酸,电子转移数为2 NA
C. 100 mL 2 mol·L-1碳酸钠溶液中,CO![]() 离子数为0.2 NA
离子数为0.2 NA
D. 7.8 g过氧化钠与水反应时转移的电子数为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
(l)冶炼废水中砷元素主要以亚砷酸(H3 AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:I .As2 S3与过量的S2一存在以下反应:As2S3(s)+3S2—(aq)![]() 2AsS33—(aq);
2AsS33—(aq);
II.亚砷酸盐的溶解性大于相应砷酸盐。
①亚砷酸中砷元素的化合价为 ;
②砷酸的第一步电离方程式为 ;
③“一级沉砷”中FeSO4的作用是 ;
④“二级沉砷”中H2O2与含砷物质反应的化学方程式为 ;
⑤沉淀X为 (填化学式)。
(2)冶炼废渣中的砷元素主要以As2O3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10 -6g)。
步骤1:取10 g废渣样品,粉碎后与锌粉混合,加人H2 SO4共热,生成H3As气体。
步骤2:将H3As气体通人AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
①AsH3的电子式为 ;
②步骤2的离子方程式为 ;
③固体废弃物的排放标准中,砷元素不得高于4.0×10一5g·kg一1,请通过计算说明该排放的废渣中砷元素的含量 (填“符合”、“不符合”)排放标准,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是
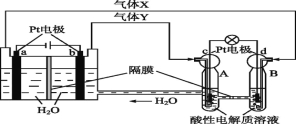
A.当有0.1 mol电子转移时,a极产生1.12 L O2(标准状况下)
B.b极上发生的电极反应是:4H2O+4e- =2H2↑+4OH-
C.c极上进行还原反应,B中的H+可以通过隔膜进入A
D.d极上发生的电极反应是:O2+4H++4e- =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组探究铜与浓硫酸的反应情况.甲.乙.丙三位同学进行了下列实验:取12.8g铜片和20ml.18mol/L的浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余外,同时根据所学的知识认为还有较多的硫酸剩余.
(1)请写出铜跟浓硫酸反应的化学方程式: ,
试问:为什么较多的余酸不再与铜片继续反应?简述理由: .
可以证明有余酸的实验方案是 (填写字母,错选或多选扣分).
a.再加入铁粉 b.再滴入BaCl2溶液
c.再加入银 d.再滴入Na2CO3溶液
(2)甲学生设计求余酸浓度的实验方案是测定产生气体的量.其方法有多种,请问下列方案中不可行的是 (填写字母,错选或多选扣分).
a.将产生的气体缓缓通过预先称量盛有碱石灰的干燥管,结束反应后再次称量.
b.将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
c.用排水法测定其产生气体的体积(折算成标准状况).
d.用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况).
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu2+的量.在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na2S溶液,充分反应后,过滤.洗涤.干燥、称量沉淀.请写出生成沉淀的离子方程式: .
(4)根据甲、乙两同学的实验方案,除测算产生气体的物质的量或反应掉的铜的物质的量外,尚缺少的测量数据是 .
(5)丙同学提出甲、乙两同学的实验方案设计的复杂,为此他设计了下列较为简易的实验方案:取出反应后的铜片,进行洗涤.干燥.称量.若称得剩余铜片的质量为Wg,测得反应后溶液的体积为Vml,请计算剩余硫酸的物质的量浓度= mol/L(用含W.V的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2008年初我国南方通遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1mol XY2含有54 mol电子。
(1)该融雪剂的化学式是______,X与氢元素形成的化合物与水反应时生成一种强碱和一种单质。写出有关反应的化学方程式___________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是__________。 D所在族元素的气态氢化物中,最稳定的是____________。
(3)元素W与Y同周期,其单质是良好的半导体材料;元素Z的单质分子Z2是空气的主要成分,常温下非常稳定;W与Z能形成一种新型无机非金属材料.其化学式是________。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的其中一种产物是OR2。该反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果实行海水淡化来供应居民饮用水,下列方法中在原理上完全不可行的是( )
A. 加明矾使海水中的盐沉淀出来而淡化
B. 利用太阳能使海水升温,通过蒸馏而使其淡化
C. 将海水缓慢降温凝固以获取淡水
D. 将海水通过离子交换树脂以除去金属阳离子及酸根阴离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com