
����Ŀ����2008����ҹ��Ϸ�ͨ���ı�ѩ�ֺ��У�ʹ����һ����ѩ��������Ҫ�ɷֵĻ�ѧʽΪXY2��X��YΪ���ڱ�ǰ20��Ԫ�أ��������Ӻ������ӵĵ��Ӳ�ṹ��ͬ����1mol XY2����54 mol���ӡ�
��1������ѩ���Ļ�ѧʽ��______��X����Ԫ���γɵĻ�������ˮ��Ӧʱ����һ��ǿ���һ�ֵ��ʡ�д���йط�Ӧ�Ļ�ѧ����ʽ___________��
��2��Ԫ��D��Eԭ�ӵ�����������������Ӳ�����2����D��Y���ڣ���D�����ӽṹʾ��ͼ��__________�� D������Ԫ�ص���̬�⻯���У����ȶ�����____________��
��3��Ԫ��W��Yͬ���ڣ��䵥�������õİ뵼����ϣ�Ԫ��Z�ĵ��ʷ���Z2�ǿ�������Ҫ�ɷ֣������·dz��ȶ���W��Z���γ�һ���������ǽ������ϣ��仯ѧʽ��________��
��4��Ԫ��R��Yͬ���壬���⻯�������ڿ�ʴ������R2��NaOH��Һ��Ӧ������һ�ֲ�����OR2���÷�Ӧ�����ӷ���ʽΪ_____________��
���𰸡� CaCl2 CaH2+2H2O=Ca(OH)2+2H2�� ![]() H2O Si3N4 2F2+2OH-=2F-+OF2+H2O
H2O Si3N4 2F2+2OH-=2F-+OF2+H2O
�������������������ӵĵ��Ӳ�ṹ��ͬ����ϻ������к��еĵ��Ӹ����жϳ�X��Y��Ȼ��������������
��1����ѩ����Ҫ�ɷֵĻ�ѧʽΪXY2��X��Y��Ϊ���ڱ�ǰ20��Ԫ�أ��������Ӻ������ӵĵ��Ӳ�ṹ��ͬ��������ͬ�ĺ������������1molXY2����54mol���ӣ������������Ӻ��������Ϊ54��3=18����ΪCa2+��Cl-����XY2��CaCl2����X��CaԪ�ء�Y��ClԪ�أ�X����Ԫ���γɵĻ�����Ļ�ѧʽ��CaH2����ˮ��Ӧ�ķ���ʽΪCaH2+2H2O=Ca(OH)2+2H2������2��Ԫ��D��Eԭ�ӵ�����������������Ӳ�����2����D����Ԫ�����ڣ���DΪ��Ԫ�أ�D�����ӽṹʾ��ͼ��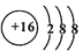 ������Ԫ������Ԫ�طǽ�������ǿ�����⻯����H2O���ȶ�����ǿ����3��Ԫ��W��Clͬ���ڣ��䵥�������õİ뵼����ϣ�W��Si��Ԫ��Z�ĵ��ʷ���Z2�ǿ�������Ҫ�ɷ֣������·dz��ȶ���Z��N��W��Z���γ�һ���������ǽ������ϣ���������+4�ۣ�N����ͼ���-3�ۣ����仯ѧʽ��Si3N4����4��Ԫ��R��Clͬ�壬���⻯�������ڿ�ʴ��������RΪFԪ�أ�F2��NaOH��Һ��Ӧ�IJ���֮һ��OF2��OF2����Ԫ��Ϊ+2��FԪ��Ϊ-1�ۣ����ݵ���غ㣬����NaF���ɣ�����Ԫ���غ���ˮ���ɣ���Ӧ���ӷ���ʽΪ��2F2+2OH-=2F-+OF2+H2O��
������Ԫ������Ԫ�طǽ�������ǿ�����⻯����H2O���ȶ�����ǿ����3��Ԫ��W��Clͬ���ڣ��䵥�������õİ뵼����ϣ�W��Si��Ԫ��Z�ĵ��ʷ���Z2�ǿ�������Ҫ�ɷ֣������·dz��ȶ���Z��N��W��Z���γ�һ���������ǽ������ϣ���������+4�ۣ�N����ͼ���-3�ۣ����仯ѧʽ��Si3N4����4��Ԫ��R��Clͬ�壬���⻯�������ڿ�ʴ��������RΪFԪ�أ�F2��NaOH��Һ��Ӧ�IJ���֮һ��OF2��OF2����Ԫ��Ϊ+2��FԪ��Ϊ-1�ۣ����ݵ���غ㣬����NaF���ɣ�����Ԫ���غ���ˮ���ɣ���Ӧ���ӷ���ʽΪ��2F2+2OH-=2F-+OF2+H2O��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�¶��£����ְ�ˮA��B��Ũ�ȷֱ���0.2 mol/L��0.1 mol/L����A��B��OH��Ũ��֮��
A������2 B��С��2 C������2 D������ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ��ԭ�ӣ�����ĸ��ʾ��������������ԭ�������Ĺ�ϵͼ��˵����ȷ���ǣ� ��

A. X��W�γɵĻ�������ֻ�й��ۼ�
B. X��Z�γɵĻ�������ֻ�����Ӽ�
C. Ԫ�صķǽ����ԣ� X��R��W
D. �����ӵİ뾶��W��R��X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У��������
A�����ǡ����ۡ���ά��ˮ������ղ��ﶼֻ��������
B������ؽ����Σ���������ţ�̻��ɽⶾ
C����֬�������������������࣬������ͬϵ��
D��ú�ĸ�����Եõ������ױ��ȷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10g Na2O2��Na2O��Na2CO3��NaOH�Ļ������100g��������Ϊ3.65%������ǡ�÷�Ӧ��������Һ�����յù�������Ϊ�� ��
A��11.7g B��5.85g C��8g D��15.5g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4 mol A�����2 mol B������2 L�������л�ϣ�����һ�������·������·�Ӧ��2A��g����B��g��![]() 2C��g������2 s����C��Ũ��Ϊ0.6 mol��L��1���������м���˵����
2C��g������2 s����C��Ũ��Ϊ0.6 mol��L��1���������м���˵����
��������A��ʾ�ķ�Ӧ��ƽ������Ϊ0.3 mol��L��1��s��1
��������B��ʾ�ķ�Ӧ��ƽ������Ϊ0.6 mol��L��1��s��1
��2 sʱ����A��ת����Ϊ70%
��2 sʱ����B��Ũ��Ϊ0.7 mol��L��1��������ȷ����
A���٢� B���٢� C���ڢ� D���ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ΪC4H10O�ı���һԪ���м���ͬ���칹�壨 ��
A. 2�� B. 3�� C. 4�� D. 5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���� �� ��
A��������״̬�£�1molNa2O2��ȫ�������������ĿΪ4 NA
B�������£�0.05molCO2��SO2���������������ԭ����Ϊ0.1 NA
C. 0.1 mol��L��1MgCl2��Һ�к��е�Mg2����Ŀһ��С��0.1NA
D��0.1 mol MnO2��������Ũ����������Ӧ����Cl2�����ԼΪ2.24 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����п��Դ�����������Һ����ɫ����������( )
A��NO3����SO42����K+��Mg2+ B��Ba2+��Mg2+�� Cl����SO42��
C��H+��K+��OH����NO3- D��H+��Na+��NO3����Cu2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com