
【题目】组成为C4H10O的饱和一元醇有几种同分异构体( )
A. 2种 B. 3种 C. 4种 D. 5种
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 汽车大量排放未经处理的尾气是造成PM2.5值升高的原因之一
B. 将自然界中游离态的硅提纯所得的晶体硅可用于制作计算机芯片
C. “海水淡化”可以解决“淡水供应危机”,向海水中加入明矾可以使海水淡化
D. 煤的气化和液化过程分别是物理变化和化学变化,产品都是清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是
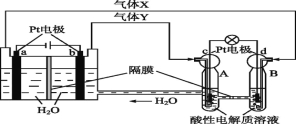
A.当有0.1 mol电子转移时,a极产生1.12 L O2(标准状况下)
B.b极上发生的电极反应是:4H2O+4e- =2H2↑+4OH-
C.c极上进行还原反应,B中的H+可以通过隔膜进入A
D.d极上发生的电极反应是:O2+4H++4e- =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2008年初我国南方通遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1mol XY2含有54 mol电子。
(1)该融雪剂的化学式是______,X与氢元素形成的化合物与水反应时生成一种强碱和一种单质。写出有关反应的化学方程式___________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是__________。 D所在族元素的气态氢化物中,最稳定的是____________。
(3)元素W与Y同周期,其单质是良好的半导体材料;元素Z的单质分子Z2是空气的主要成分,常温下非常稳定;W与Z能形成一种新型无机非金属材料.其化学式是________。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的其中一种产物是OR2。该反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
下列说法中错误的是( )
A.①②中除加试剂外,还需要进行过滤操作
B.a、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果实行海水淡化来供应居民饮用水,下列方法中在原理上完全不可行的是( )
A. 加明矾使海水中的盐沉淀出来而淡化
B. 利用太阳能使海水升温,通过蒸馏而使其淡化
C. 将海水缓慢降温凝固以获取淡水
D. 将海水通过离子交换树脂以除去金属阳离子及酸根阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 熔融时能导电的物质一定是离子化合物
B. NaOH、H2SO4溶于水均克服了离子键
C. CO2、NCl3中所有原子最外层都满足8电子结构
D. 金刚石和足球烯是同素异形体,熔化只克服共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3 (aq)+S(s)![]() Na2S2O3 (aq)
Na2S2O3 (aq)
实验步骤:
① 称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。 另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
② 安装实验装置(如图所示,部分夹持装置略去),水浴加热, 微沸60分钟。

③ 趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、低温干燥,得到产品。
回答问题:
(1) Na2S2O3 中硫元素的化合价为_____________;Na2S2O3在强酸性溶液中不能稳定存在,其原因为___________________(用离子方程式表示)。
(2)仪器a的名称是________,其作用是________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是________。检验其是否存在的方法是___________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂, 用0.100 0 mol·L-1碘的标准溶液滴定(反应原理为:2S2O![]() +I2===S4O
+I2===S4O![]() +2I-)。
+2I-)。
(4)滴定至终点时,溶液颜色的变化:_____________。
(5)滴定结束后消耗碘的标准溶液体积为20.00mL。产品的纯度为(用含W的代数式表示)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是( )

A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com