
【题目】将等量的N2和H2的混合气体分别充入甲、乙、丙三个容器中,进行反应![]() ,经过相同的时间后,测得反应速率分别为甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率大小关系为( )
,经过相同的时间后,测得反应速率分别为甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率大小关系为( )
A.v(甲)>v(乙)>v(丙)B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙)D.v(乙)>v(甲)>v(丙)
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于离子方程式或离子共存的说法中正确的是![]()
A.向 ![]() 溶液中加入稀
溶液中加入稀 ![]() :
:![]()
B.![]() 溶液中加入足量
溶液中加入足量 ![]() 溶液:
溶液:![]()
C.某溶液中只存在以下 4种离子:![]() 、
、![]() 、
、![]() 、R离子
、R离子![]() 忽略微量的
忽略微量的 ![]() ,且浓度均为
,且浓度均为 ![]() ,则 R离子可能为
,则 R离子可能为 ![]()
D.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 能大量共存。
能大量共存。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第四周期ⅥA族元素,是人体内不可或缺的微量元素,其氢化物H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的基础原料。
T℃时,向一恒容密闭容器中加入3molH2和lmolSe,发生反应H2(g)+Se(s)![]() H2Se(g)。
H2Se(g)。
①当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为液体H2Se,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是![]()
A.氯化钙溶液中通入![]() 气体:
气体:![]()
B.以石墨作电极电解氯化铝溶液:![]()
![]()
![]()
C.![]() 溶液中通入过量的
溶液中通入过量的![]() 气体:
气体:![]()
D.向明矾溶液中加入氢氧化钡溶液至沉淀的质量最大:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.尿素[CO(NH2)2]是人工合成的第一种有机物。
(1)尿素中所含元素的电负性最大的是______,尿素分子间的氢键可表示为______。
(1)尿素可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
①与铁同周期且未成对电子数与Fe3+相同的元素是______。
②[Fe(H2NCONH2)6](NO3)3中存在的化学键______![]() 填序号
填序号![]() 。
。
A.离子键B.金属键C.配位键D.σ键E.π键
③![]() 中N原子杂化后的价电子排布图为______,
中N原子杂化后的价电子排布图为______,![]() 的空间构型为______。
的空间构型为______。
Ⅱ.Mg2NiH4是一种贮氢的金属氢化物
(3) Mg2NiH4可通过氢化镁和镍单质球磨制成。在Mg2NiH4晶胞中,Ni原子占据如图的顶点和面心, Mg2+处于如图八个小立方体的体心。
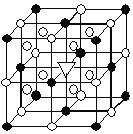
①Mg2NiH4中H的化合价为______。
②Mg2+位于Ni原子形成的______ (填“八面体空隙”或“四面体空隙”)。
③若晶体的密度为d g·cm-3,Mg2NiH4的摩尔质量为M g·mol-1,则Mg2+和Ni原子的最短距离为______nm(用含d、M的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示可逆反应A(g)+3B(g)2C(g) △H<0达平衡后,t1时改变某一反应条件,反应速率随时间变化的情况,根据曲线判断下列说法中正确的是( )
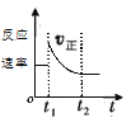
A.t1时降低了温度,平衡向正反应方向移动
B.t1时增大了压强,平衡向正反应方向移动
C.t1时可能使用了催化剂
D.t1时增大了A的浓度,同时减小了C的浓度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3+、-CH3、CH3-都是重要的有机反应中间体,有关它们的说法不正确的是
A.它们均由甲烷去掉一个氢原子所得
B. CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形
C. CH3+中的碳原子采取sp2杂化,所有原子均共面
D.两个-CH3或一个CH3+和一个CH3-结合均可得到CH3CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活有密切联系,下列说法正确的是![]()
A.酸雨易导致土壤胶粒吸附![]() 使土壤酸化,影响铵态氮肥和钾肥的有效利用
使土壤酸化,影响铵态氮肥和钾肥的有效利用
B.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的
C.高纯度的单晶硅用于制造登月车的光电池和光导纤维
D.铝及其合金是电气、工业、家庭广泛使用的材料,通常用电解氯化铝的方法制取铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=___。已知:K300℃>K350℃,则该反应是___热反应。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是___
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com