
【题目】化学与生活有密切联系,下列说法正确的是![]()
A.酸雨易导致土壤胶粒吸附![]() 使土壤酸化,影响铵态氮肥和钾肥的有效利用
使土壤酸化,影响铵态氮肥和钾肥的有效利用
B.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的
C.高纯度的单晶硅用于制造登月车的光电池和光导纤维
D.铝及其合金是电气、工业、家庭广泛使用的材料,通常用电解氯化铝的方法制取铝
科目:高中化学 来源: 题型:
【题目】T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1 ℃和T2 ℃时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
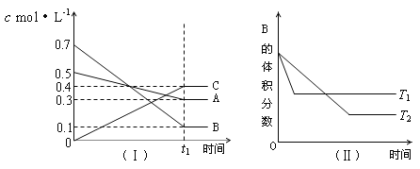
A.该平衡体系的化学反应方程式为:A(g)+B(g)![]() C(g)
C(g)
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动
C.T1<T2
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等量的N2和H2的混合气体分别充入甲、乙、丙三个容器中,进行反应![]() ,经过相同的时间后,测得反应速率分别为甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率大小关系为( )
,经过相同的时间后,测得反应速率分别为甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率大小关系为( )
A.v(甲)>v(乙)>v(丙)B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙)D.v(乙)>v(甲)>v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行实验,能实现实验目的的是(必要时可加热)( )
选项 | 实验目的 | 甲中物质 | 乙中物质 | 丙中物质 |
|
A | 证明浓硫酸具有强氧化性 | 浓硫酸 | 碳粉 | 溴水 | |
B | 验证Cl2无漂白性 | 浓盐酸 | MnO2 | 干燥的红色布条 | |
C | 比较H2CO3和H2SiO3的酸性 | 稀硫酸溶液 | 碳酸钠 | 硅酸钠溶液 | |
D | 验证NH3溶于水显碱性 | 浓氨水 | 碱石灰 | 湿润的蓝色 石蕊试纸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
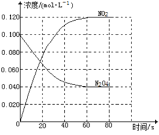
(1)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,经10s又达到平衡。T___100℃(填“大于”“小于”),判断理由是___。
(2)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___(填“正反应”或“逆反应”)方向移动,判断理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯A中盛放0.1mol/L的H2SO4溶液,烧杯B中盛放0.1mol/L的的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是( )
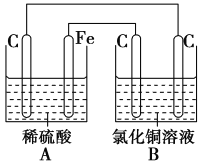
A.A为原电池,B为电解池
B.A为电解池,B为原电池
C.当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
D.经过一段时间,B烧杯中溶液的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入1molH2和1molI2,压强为P(Pa),并在一定温度下反应:H2(g)+I2(g)![]() 2HI(g)△H<0.写出下列条件下反应速率的变化(填“增大”,“减小”或“不变”)
2HI(g)△H<0.写出下列条件下反应速率的变化(填“增大”,“减小”或“不变”)
(1)容积不变,加入1molH2,其正反应速率的变化是___。
(2)升高温度,其逆反应速率的变化是___。
(3)压强不变,加入1molHe,其正反应速率的变化是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是( )
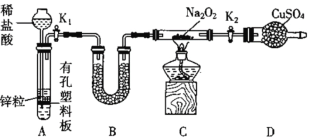
A.若D中无水硫酸铜变蓝,则说明Na2O2与H2反应生成水
B.装置B中盛放浓硫酸,目的是除去A中挥发出来的少量水蒸气
C.装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D.装置A也可直接用于二氧化锰与浓盐酸反应制取氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
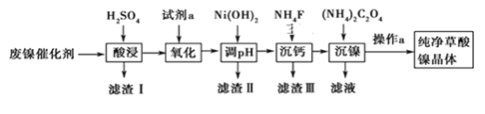
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)在酸浸过程中会适当增大酸的浓度并不断快速搅拌,目的是______________。
(2)写出“沉镍”时发生反应的离子方程式:______________________________,当Ca2+沉淀完全时,溶液中 c(F-)> ________mol·L-1(写出计算式即可)。
(3)试剂a是一种绿色氧化剂,写出“氧化”时反应的化学反应方程式:_______________________________。
(4)操作a的内容包括过滤,洗涤,干燥。请用简洁语言描述洗涤的方法是__________________________。
(5)“调pH”时pH的调控范围为______≤PH<6.8。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com