
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是( )
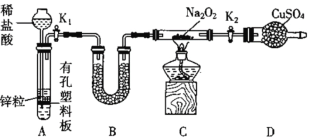
A.若D中无水硫酸铜变蓝,则说明Na2O2与H2反应生成水
B.装置B中盛放浓硫酸,目的是除去A中挥发出来的少量水蒸气
C.装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D.装置A也可直接用于二氧化锰与浓盐酸反应制取氯气
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
A. 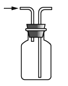 收集 NOB.
收集 NOB.  制备 NH3
制备 NH3
C.  制备 Fe(OH)2D.
制备 Fe(OH)2D. 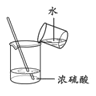 稀释浓 H2SO4
稀释浓 H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+。在bL FeBr2溶液中通入amol Cl2时,使溶液中50% 的Br﹣氧化为Br2,则原FeBr2的物质的量浓度为
A. a/bmolL﹣1 B. 2a/bmolL﹣1 C. 3a/bmolL﹣1 D. 5a/bmolL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是向MgCl2、AlCl3混合溶液中,开始滴加7mL试剂A,之后改滴试剂B,所得沉淀y(mol)与试剂体积V(mL)间的关系.以下结论不正确的是( )

A. A是NaOH,B是盐酸,且c(NaOH)︰c(HCl)=2︰1
B. 原混合液中,c(Al3+)︰c(Mg2+)︰c(Cl-)=1︰1︰5
C. A是NaOH,B是盐酸,且c(NaOH)︰c(HCl)=1︰2
D. 从6到9,相应离子反应式H+ + OH-===H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )

A. 锌电极上发生的反应:Zn2++2e-===Zn
B. 电池工作一段时间后,甲池的c(SO![]() )减小
)减小
C. 电流由锌电极经电流表流向铜电极
D. 电池工作一段时间后,乙池溶液的总质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质结构有关性质和特点,回答下列问题:
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。
(2)Na3AsO3可用于碘的微量分析。Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3)丙烯腈(CH2=CH-CN)分子中碳原子轨道杂化类型是____________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)钛存在两种同素异形体,α—Ti采纳六方最密堆积,β—Ti采纳体心立方堆积,由α—Ti转变为β—Ti晶体体积____________(填“膨胀”或“收缩”)。
(6)某镍白铜合金的立方晶胞结构如图所示。若合金的密度为d g·cm-3,晶胞参数a=______ nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置关系如图所示。下列判断正确的是
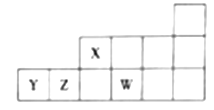
A. 原子半径:rW>rZ>rY>rX
B. 最高价氧化物对应水化物的酸性:Z>X>Y
C. X、Z、W形成的简单氢化物中X的氢化物沸点最高
D. W与Y元素形成的化合物在水溶液中能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是生活中常见的金属,请回答下列问题:
(1)Cu不活泼,通常情况下不与稀硫酸反应,但向Cu和稀硫酸的混合物中滴入H2O2溶液后,溶液很快变蓝色,试写出该反应的离子方程式_____________________________________________________________。
(2)将硫酸铜溶液和碳酸钠溶液混合,会析出Cu2(OH)2CO3绿色固体,试写出该反应的离子方程式________________________________。
(3)火法炼铜的原理:Cu2S+O2高温,2Cu+SO2,在该反应中每生成1 mol Cu,转移________mol e-。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________(填选项字母)。
a.粗铜接电源正极,发生氧化反应
b.溶液中Cu2+向阴极移动
c.电解过程中,阳极和阴极的质量变化相等
d.利用阳极泥可回收Al、Zn等金属
(5)据报道,有一种叫Thibacillus Ferroxidans的细菌在有氧气存在的酸性溶液中,可将黄铜矿中CuFeS2氧化成硫酸盐:4CuFeS2+2H2SO4+17O2===4CuSO4+2Fe2(SO4)3+2H2O。利用反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
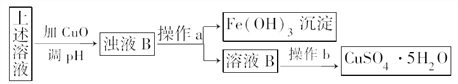
①检验溶液B中Fe3+是否被除尽的实验方法___________________________________________。
②在实验室中,设计两个原理不同的方案,从溶液B中提炼金属铜(要求:一种方案只用一个反应来完成)。写出两种方案中涉及的化学方程式
方案一:___________________________________________;
方案二:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:

(1)写出OA段和BC段反应的离子方程式:
OA:___________ ; BC:_____________;
(2)原Mg-Al合金的质量是_____________。
(3)原HCl溶液的物质的量浓度是________________。
(4)所加NaOH溶液的物质的量浓度是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com