
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中不正确的是(忽略混合前后溶液体积变化)
A.溶液的pH值:②>③>①
B.水电离出的c(OH﹣):③>①>②
C.①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO﹣)=0.1mol/L
D.②和③等体积混合后的溶液:c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)
科目:高中化学 来源:2016-2017学年宁夏高二上月考二化学卷(解析版) 题型:选择题
分子式为C8H802的芳香族化合物中属于酯的有机物有(不考虑立体结构) ( )
A. 3种 B. 4种 C. 5种 D. 6种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一12月月考化学试卷(解析版) 题型:选择题
由氢氧化钠(NaOH)和过氧化钠(Na202)组成混合物中检测出氢元素的质量分数为2.5%,那么混合物中钠元素的质量分数为
A.46% B.57.5% C.58.4% D.无法计算
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一12月月考化学试卷(解析版) 题型:选择题
钠及其化合物在生活和化工生产中具有广泛的用途,下列说法正确的是
A.所有碳酸氢盐的溶解度都比相应的碳酸盐大
B.用饱和碳酸氢钠制造灭火剂比用饱和碳酸钠制造灭火剂的效果好
C.碳酸钠可用于制造洗涤剂,因为碳酸钠是碱
D.五彩缤纷的焰火是K单质燃烧所致
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二12月月考化学试卷(解析版) 题型:选择题
常温下,0.1mol·L﹣1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
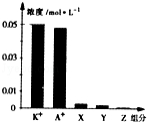
A.该混合溶液pH=7.0
B.原HA溶液中:c(HA)>c(H+)>c(A﹣)
C.图中X表示HA,Y表示OH﹣,Z表示H+
D.混合溶液中:c(X)+x(A﹣)=c(K+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二12月月考化学试卷(解析版) 题型:选择题
下列关于氢氧化钠与醋酸两种稀溶液的说法正确的是
A.相同浓度的两溶液中由水电离出的c(H+)相同
B.pH=12与pH=2的两溶液稀释100倍,pH都变化2个单位
C.用20mL0.1mol/L的氢氧化钠滴定未知浓度的醋酸,选用酚酞作指示剂
D.两溶液相互反应生成1molH2O的中和热为57.3kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一上期中化学试卷(解析版) 题型:实验题
I.为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。其中正确的操作顺序是 。
A①④②⑤③ B④①②⑤③ C②⑤④①③ D⑤②④①③ E①②⑤④③
II.实验室里需 要纯净的氯化钠溶液,现只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案:
要纯净的氯化钠溶液,现只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案:

(1)操作①中发生的化学反应方程式为:NH4HCO3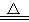 NH3↑+CO2↑+H2O↑
NH3↑+CO2↑+H2O↑
则可选择________容器进行加热(选填:试管、量筒、容量瓶、分液漏斗)
(2)操作②反应的化学反应方程式为: ,能否用硝酸钡溶液代替氯化钡 (填“能”或“不能”)原因是: ;
(3)为了达到实验目的,进行操作②后,如何判断溶液中SO42-已除尽,其方法有_________。
A.静置,向上层清液中滴加硫酸钠,若有沉淀生成,则说明原溶液中的SO42-已除尽
B.静置,取上层清液于试管中,滴加硫酸钠,若有沉淀生成,则说明原溶液中的SO42-已除尽
C.静置,向上层清液中滴加氯化钡溶液,若无沉淀生成,则说明原溶液中的SO42-已除尽
D.静置,取上层清液于试管中,滴加氯化钡溶液,若无沉淀生成,则说明原溶液中的SO42-已除尽
E.静置,取上层清液于试管中,滴加硝酸银溶液,若有沉淀生成,则说明原溶液中的SO42-已除尽
查看答案和解析>>
科目:高中化学 来源:2016-2017年陕西西藏民族学院附中高二12月月考化学卷(解析版) 题型:填空题
能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知反应:
N2(g)+3H2(g) 2NH3(g) △H=-93 kJ/mol。
2NH3(g) △H=-93 kJ/mol。
试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
化学键 | H-H | N-H | N≡N |
键kJ/mol | 436 | a | 945 |
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。已知在常压下有如下变化:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =a kJ/mol
②H2O(g)=H2O(l) ΔH =b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式: 。
(3)己知:HCN(aq)与NaOH(aq)反应的焓变 △H=-12.1 kJ·mol-1;HCl(aq)与 NaOH(aq)反应的焓变△H=-55.6 kJ·mol-1。则HCN在水溶液中电离的焓变△H等于 。
(4) 己知:H2(g)+1/2O2(g)=H2O(I) △H =-285.83 kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H =-282.9 kJ/mol
若氢气与一氧化碳的混合气体完全燃烧可生成5.4gH2O(I),并放出114.3kJ热量,则混合气体中CO的物质的量为 (计算结果保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com