
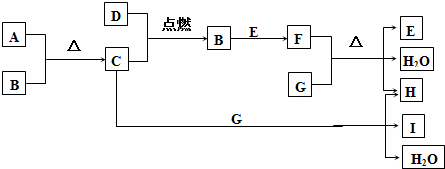
分析 A为黑色粉末状固体物质,常用作氯酸钾分解制氧气的催化剂,则A为MnO2,A与B反应得到C,D在C中燃烧生成B,火焰呈苍白色,则B为HCl,C为Cl2,D为H2,G为焰色反应呈黄色的强碱,则G为NaOH,G与氯气反应生成NaCl、NaClO与水,E与B接触有大量白烟产生,反应生成F,且F与G反应的E与H,可推知E为NH3、F为NH4Cl、H为NaCl、I为NaClO,据此解答.
解答 解:A为黑色粉末状固体物质,常用作氯酸钾分解制氧气的催化剂,则A为MnO2,A与B反应得到C,D在C中燃烧生成B,火焰呈苍白色,则B为HCl,C为Cl2,D为H2,G为焰色反应呈黄色的强碱,则G为NaOH,G与氯气反应生成NaCl、NaClO与水,E与B接触有大量白烟产生,反应生成F,且F与G反应的E与H,可推知E为NH3、F为NH4Cl、H为NaCl、I为NaClO.
(1)由上述分析可知,A为MnO2,E为NH3,G为NaOH,I为NaClO,
故答案为:MnO2;NH3;NaOH;NaClO;
(2)A+B→C的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)C+G→H+I+H2O的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查无机物推断,A的颜色与用途、一些反应现象是推断突破口,熟练掌握元素化合物知识,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| B. | 钢铁吸氧腐蚀时,负极反应式为2H2O+O2+4e-═4OH- | |
| C. | 向醋酸钠溶液中加入适量醋酸至混合液pH=7时,溶液中c(Na+)=c(CH3COO-) | |
| D. | 0.1 mol/L NH4Cl溶液中,c(NH${\;}_{4}^{+}$)+c(H+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
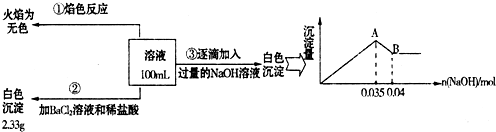
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸在常温下能迅速与铜片反应放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能干燥二氧化硫、氢气、氨气等气体 | |
| D. | 浓硫酸在常温下能够使铁、铝表面形成氧化膜而钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
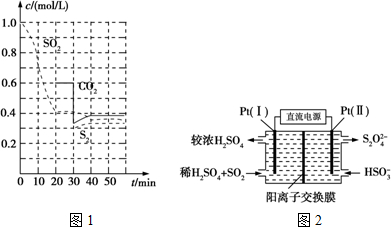
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 左盘下沉 | B. | 右盘下沉 | C. | 仍保持平衡 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2SO4溶于水中,所得溶液中Na+个数为NA | |
| B. | 18g水含有电子数为8NA | |
| C. | 1L 0.3mol•L-1Na2SO4溶液中,含有Na+和SO42-总数为0.9NA | |
| D. | 1个氢气分子(H2)的质量为2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com