
| 11.2L |
| 22.4L/mol |
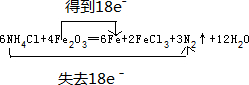 ,故答案为:12H2O;
,故答案为:12H2O;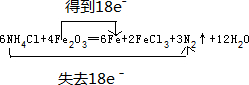 ;
;| 18NA |
| 3 |
| a |
| b |
| a |
| 6b |
| a |
| 6b |
| 11.2L |
| 22.4L/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、上述反应的平衡常数随温度升高而增大 |
| B、上述反应达到平衡后,只增大氧气浓度,因为K值变大了,所以平衡将向左移动 |
C、N2O5与苯发生硝化反应除了生成硝基苯(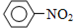 ),还有氧气生成 ),还有氧气生成 |
| D、以N2O4等为原料采用电化学方法可以合成N2O5,该合成应避免碱性环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
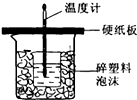 I.已知中和热是指酸跟碱发生中和反应生成lmol H2O时的反应热.
I.已知中和热是指酸跟碱发生中和反应生成lmol H2O时的反应热.| 实验起始温度(℃) | 实验中止温度(℃) | |
| 实验① | 25.00 | 28.64 |
| 实验② | 25.00 | 28.52 |
| 实验③ | 25.00 | 29.66 |
查看答案和解析>>
科目:高中化学 来源: 题型:
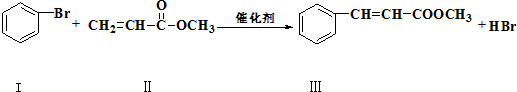
| 浓H2SO4 |
| △ |
| CH3OH |
| 浓H2SO4△ |

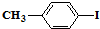 和
和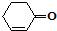 也可以发生类似如图的反应,有机产物的结构简式
也可以发生类似如图的反应,有机产物的结构简式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com