
| A、上述反应的平衡常数随温度升高而增大 |
| B、上述反应达到平衡后,只增大氧气浓度,因为K值变大了,所以平衡将向左移动 |
C、N2O5与苯发生硝化反应除了生成硝基苯(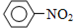 ),还有氧气生成 ),还有氧气生成 |
| D、以N2O4等为原料采用电化学方法可以合成N2O5,该合成应避免碱性环境 |
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| A、淀粉、油脂和蛋白质都能发生水解反应 |
| B、糖类、油脂和蛋白质都属于高分子化合物 |
| C、氨基酸既可以与盐酸反应,也能与NaOH反应 |
| D、采用多次盐析和溶解,可以分离提纯蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将体积均为100mL、浓度均为0.1mol/L的Ba(OH)2溶液与Na2SO4溶液混合,若混合后溶液的体积为100mL,则所得溶液的pH=13 |
| B、将等体积等浓度的醋酸与CH3COONa溶液混合,所得溶液中:c(Na+)+c(H+)═c(CH3COO-)+c(OH-) |
| C、将等体积等浓度的Na2CO3溶液与NaHCO3溶液混合,所得溶液中:2c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、将等体积等浓度的Na2CO3溶液与NaOH溶液混合,所得溶液中:c(Na+)>c(OH-)>c(CO32-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
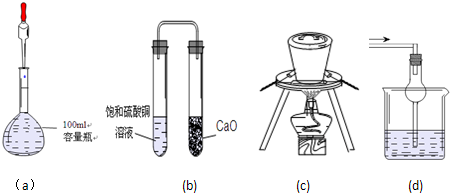
| A、(a) 可用于定容并量取15.00 mL NaOH溶液 |
| B、(b)装置放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
| C、(c)可用于高温煅烧石灰石 |
| D、(d)可用于易溶于水的尾气吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com