
| n |
| V |
| 1000ρω |
| M |
| 1000ρω |
| M |
| 1000×1.84g/ml×98% |
| 98g/mol |
| n |
| V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
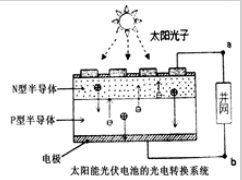
| A、光伏电池是将太阳能直接转变为电能 |
| B、图中N型半导体为正极,P型半导体为负极 |
| C、电流从a流向b |
| D、LED中的Ga和Y都显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从溴水中提取溴可用植物油做萃取剂 |
| B、用热的纯碱溶液可区别植物油和矿物油 |
| C、含Ca2+、Mg2+的水使肥皂去污能力减弱是因为发生了沉淀反应 |
| D、生产盐酸和人造脂肪必须用氢气做原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
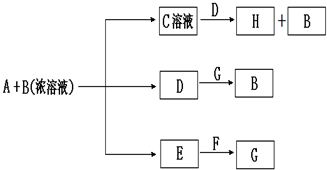
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(NH3)=0.3mol/(L?min) |
| B、v (N2)=0.2 mol/(L?min) |
| C、v (N2)=0.01mol/(L?s) |
| D、v (H2)=0.3 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度 (mol/L) | NaOH物质的量浓度 (mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述反应的平衡常数随温度升高而增大 |
| B、上述反应达到平衡后,只增大氧气浓度,因为K值变大了,所以平衡将向左移动 |
C、N2O5与苯发生硝化反应除了生成硝基苯(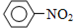 ),还有氧气生成 ),还有氧气生成 |
| D、以N2O4等为原料采用电化学方法可以合成N2O5,该合成应避免碱性环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com