
| 实验编号 | HA物质的量浓度 (mol/L) | NaOH物质的量浓度 (mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
| 10-14 |
| 10-9 |


科目:高中化学 来源: 题型:
| A、O2的能量一定高于SO2的能量 |
| B、2molSO2和1molO2的总能量一定高于2molSO3的总能量 |
| C、SO2的能量一定高于SO3的能量 |
| D、因该反应为放热反应,故不必加热就可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、WX2分子中所有原子最外层都已满足8电子结构 |
| B、WX2、ZX2的化学键类型相同 |
| C、原子半径大小顺序为:X<W<Y<Z |
| D、乙醇、乙酸、葡萄糖、油脂中均含W、X两种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液中离子浓度的关系满足:c(H+)═c(OH-)+c(CH3COO-) |
| B、醋酸溶液中加入少量醋酸钠晶体,醋酸电离程度减小 |
| C、0.1mol/L的醋酸溶液中加水稀释,溶液中c(OH-)减小 |
| D、常温下,pH=3的醋酸溶液与pH=11的烧碱溶液等体积混合后,溶液中c(H+)<c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将体积均为100mL、浓度均为0.1mol/L的Ba(OH)2溶液与Na2SO4溶液混合,若混合后溶液的体积为100mL,则所得溶液的pH=13 |
| B、将等体积等浓度的醋酸与CH3COONa溶液混合,所得溶液中:c(Na+)+c(H+)═c(CH3COO-)+c(OH-) |
| C、将等体积等浓度的Na2CO3溶液与NaHCO3溶液混合,所得溶液中:2c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、将等体积等浓度的Na2CO3溶液与NaOH溶液混合,所得溶液中:c(Na+)>c(OH-)>c(CO32-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
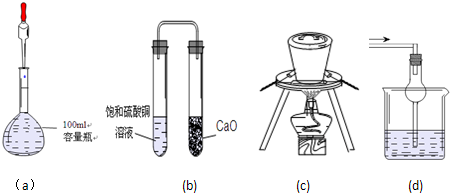
| A、(a) 可用于定容并量取15.00 mL NaOH溶液 |
| B、(b)装置放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
| C、(c)可用于高温煅烧石灰石 |
| D、(d)可用于易溶于水的尾气吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中各物质均由常见元素(原子序数≤20)组成.已知A、B、K为单质,且在常温下A和K为气体,B为固体.D为常见的无色液体.I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生.J是一种实验室常用的干燥剂.它们的相互转化关系如图所示(图中反应条件未列出).
如图中各物质均由常见元素(原子序数≤20)组成.已知A、B、K为单质,且在常温下A和K为气体,B为固体.D为常见的无色液体.I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生.J是一种实验室常用的干燥剂.它们的相互转化关系如图所示(图中反应条件未列出).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com