
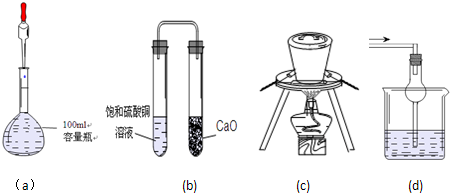
| A、(a) 可用于定容并量取15.00 mL NaOH溶液 |
| B、(b)装置放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
| C、(c)可用于高温煅烧石灰石 |
| D、(d)可用于易溶于水的尾气吸收 |


科目:高中化学 来源: 题型:
| A、0.560L |
| B、1.12L |
| C、2.24L |
| D、3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度 (mol/L) | NaOH物质的量浓度 (mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、XY |
| B、X2Y |
| C、XY2 |
| D、XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述反应的平衡常数随温度升高而增大 |
| B、上述反应达到平衡后,只增大氧气浓度,因为K值变大了,所以平衡将向左移动 |
C、N2O5与苯发生硝化反应除了生成硝基苯(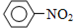 ),还有氧气生成 ),还有氧气生成 |
| D、以N2O4等为原料采用电化学方法可以合成N2O5,该合成应避免碱性环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:
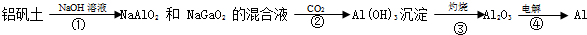
查看答案和解析>>
科目:高中化学 来源: 题型:
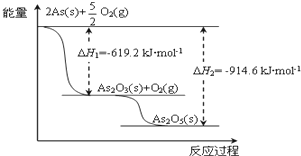 氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用.砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界.试回答下列问题:
氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用.砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
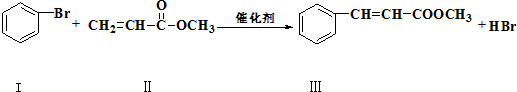
| 浓H2SO4 |
| △ |
| CH3OH |
| 浓H2SO4△ |

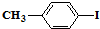 和
和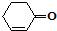 也可以发生类似如图的反应,有机产物的结构简式
也可以发生类似如图的反应,有机产物的结构简式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com